Гост 25874: «Р 78.36.008-99. Проектирование и монтаж систем охранного телевидения и домофонов. Рекомендации» (утв. ГУВО МВД РФ 27.06.1998)
Законы :: ГОСТ 28312-89 (СТ СЭВ 6415-88, МЭК 417-73) Аппаратура радиоэлектронная профессиональная. Условные графические обозначенияПостановление Госстандарта СССР от 27.10.1989 N 3223ГОСТ от 1989-10-27 N 28312-89
|
Начертание символа |
Номер, наименование, условные габаритные размеры и область применения символа | ||
|
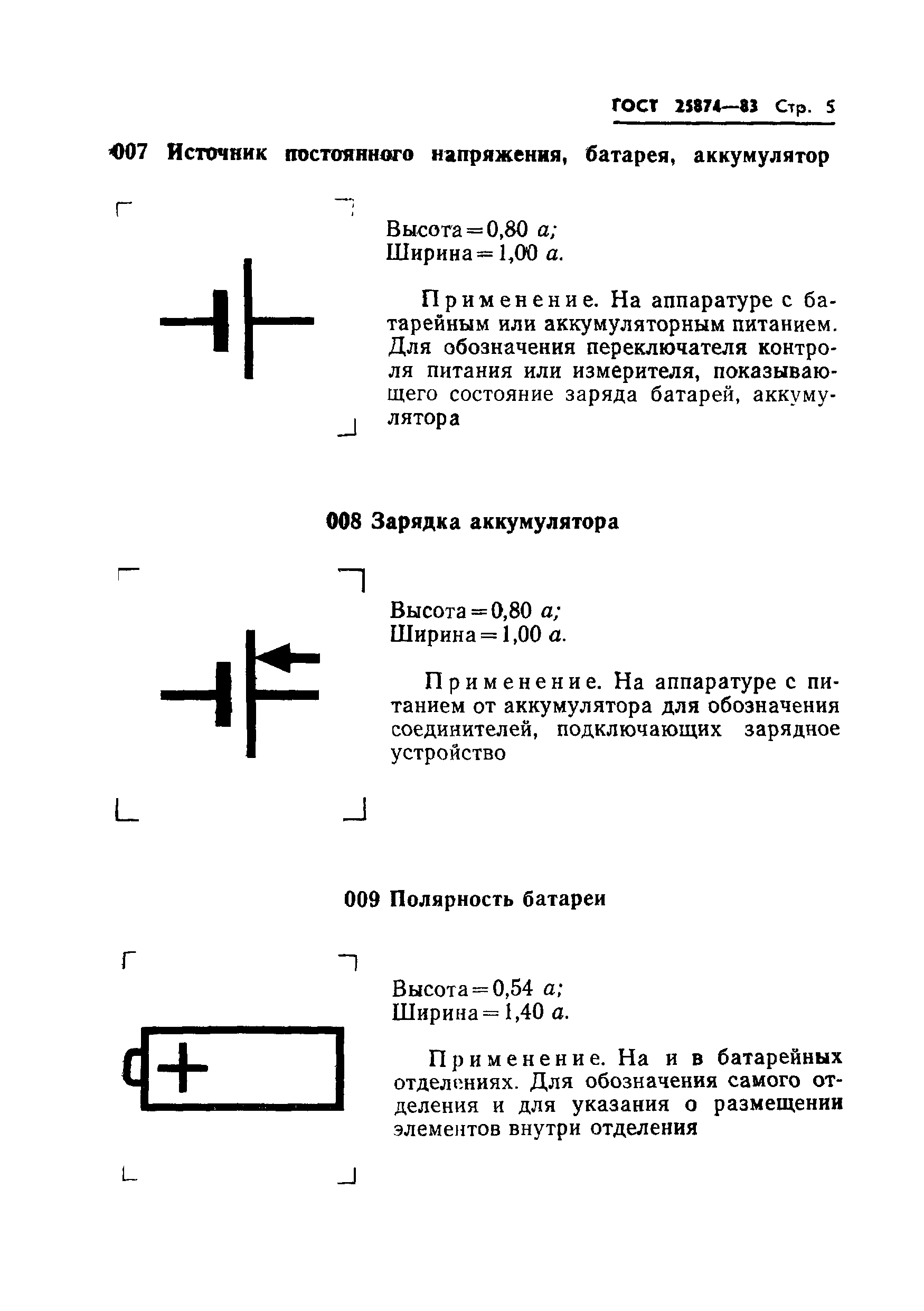
001* |
Усилитель операционный: высота = 1,04 **; ширина = 1,04 . | ||
|
Применяется для обозначения операционного усилителя | |||
|
_______________ | |||
|
002 |
Преобразователь со стабилизированным выходным напряжением: высота = 1,04 ; ширина = 1,04 . | ||
|
Применяется для обозначения преобразователя переменного напряжения в стабилизированное напряжение постоянного тока | |||
|
003 |
Преобразователь со стабилизированным выходным током: высота = 1,04 ; ширина = 1,04 . | ||
Применяется для обозначения преобразователя переменного тока в стабилизированный постоянный ток | |||
|
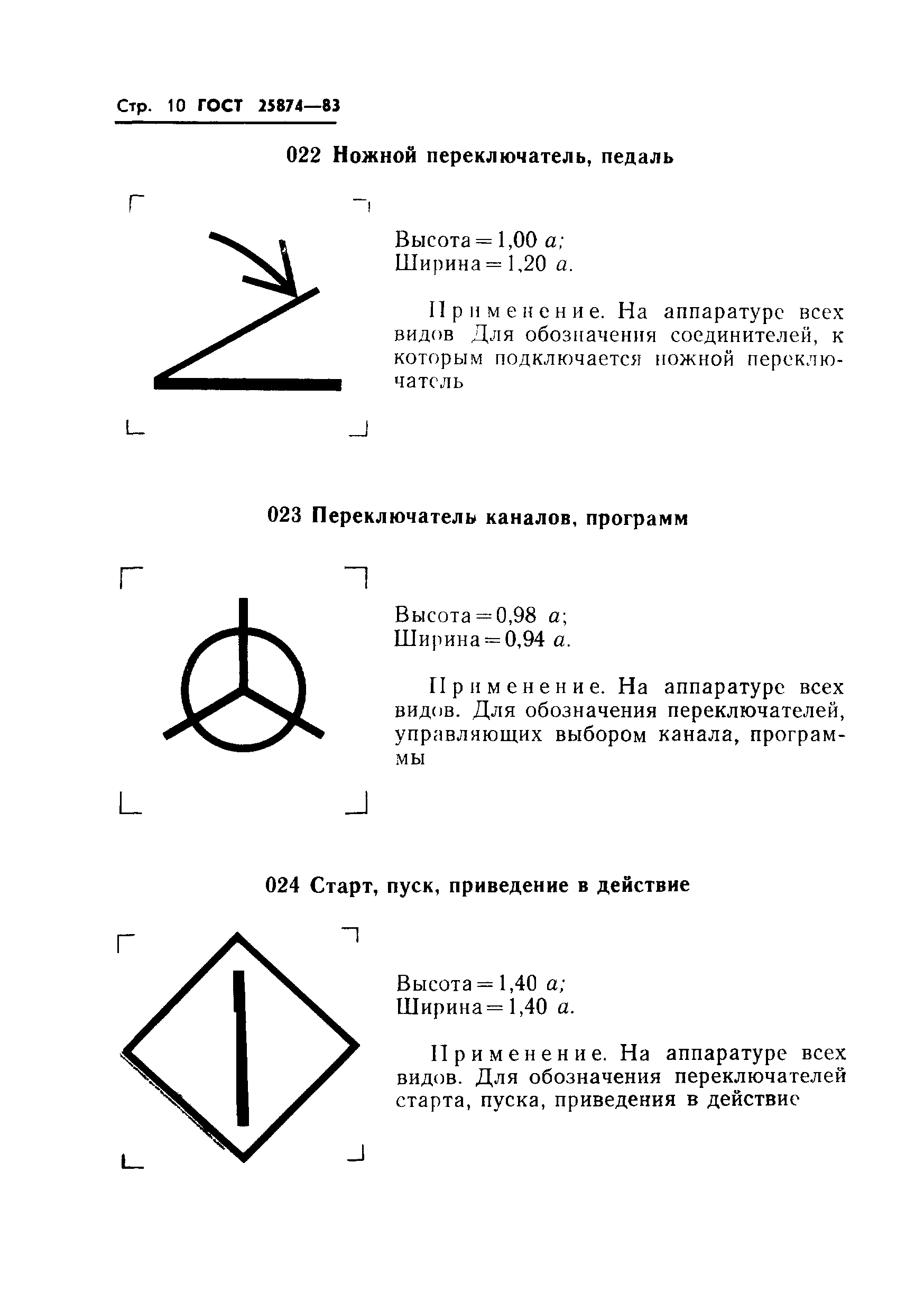
004 |
Разрядник защиты от перенапряжения: высота = 1,04 ; ширина = 1,04 . | ||
|
Применяется для обозначения устройства, обеспечивающего защиту от перенапряжения (например на линиях передачи для защиты от удара молнии) | |||
|
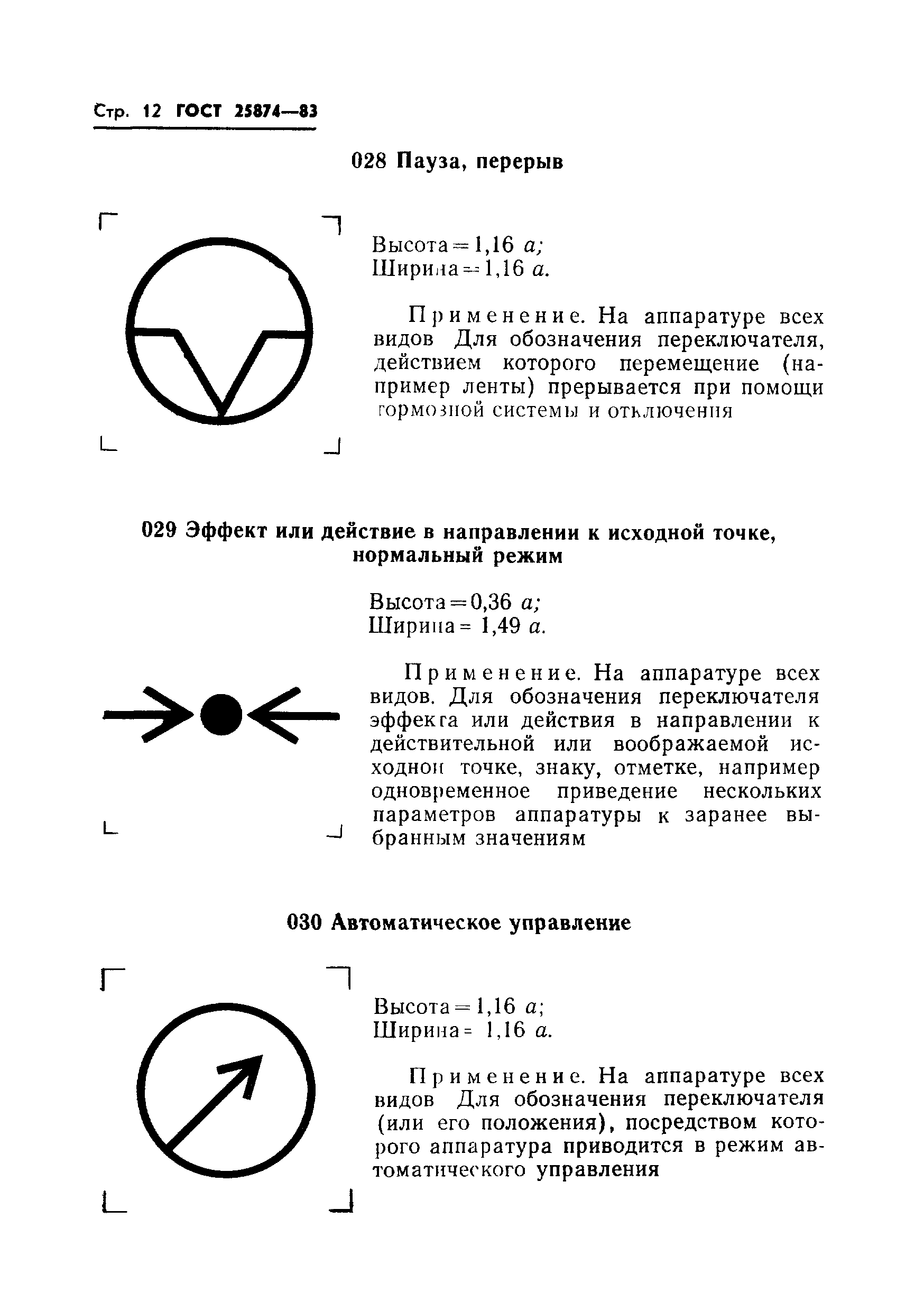
|
005 |
Устройство, содержащее логические элементы: высота = 1,04 ; ширина = 1,04 . | |
|
Применяется для обозначения устройств, выполняющих логические операции | |||
|
006 |
Блок выборки: высота = 1,04 ; ширина = 1,04 . | ||
|
Применяется для обозначения блока выборки | |||
|
007 |
Устройство регулируемое: высота = 1,34 ; ширина = 1,25 . | ||
|
Применяется на аппаратуре связи для обозначения регулируемого устройства. Обозначение может быть дополнено буквенным или графическим символом | |||
|
008 |
высота = 1,04 ; ширина = 1,04 . | ||
|
Применяется на аппаратуре связи для обозначения пассивного блока, который соединяет два других блока без изменения сигнала, передаваемого от одного блока к другому | |||
|
009 |
Усилитель на лампе бегущей волны: высота = 1,04 ; ширина = 1,04 . | ||
|
Применяется на аппаратуре связи для обозначения усилителя на лампе бегущей волны | |||
|
010 |
Передатчик сигнализации: высота = 1,18 ; ширина = 1,04 . | ||
|
Применяется на аппаратуре связи для обозначения устройства, передающего электрический сигнал сигнализации | |||
|
011 |
Приемник сигнализации: высота = 1,19 ; ширина = 1,04 . | ||
Применяется на аппаратуре связи для обозначения устройства, принимающего электрический сигнал сигнализации | |||
|
012 |
Переключатель каналов с логическим управлением: высота = 1,04 ; ширина = 1,04 . | ||
|
Применяется на аппаратуре связи для обозначения переключателя каналов «1 из «, управляемого логическими переключательными схемами | |||
|
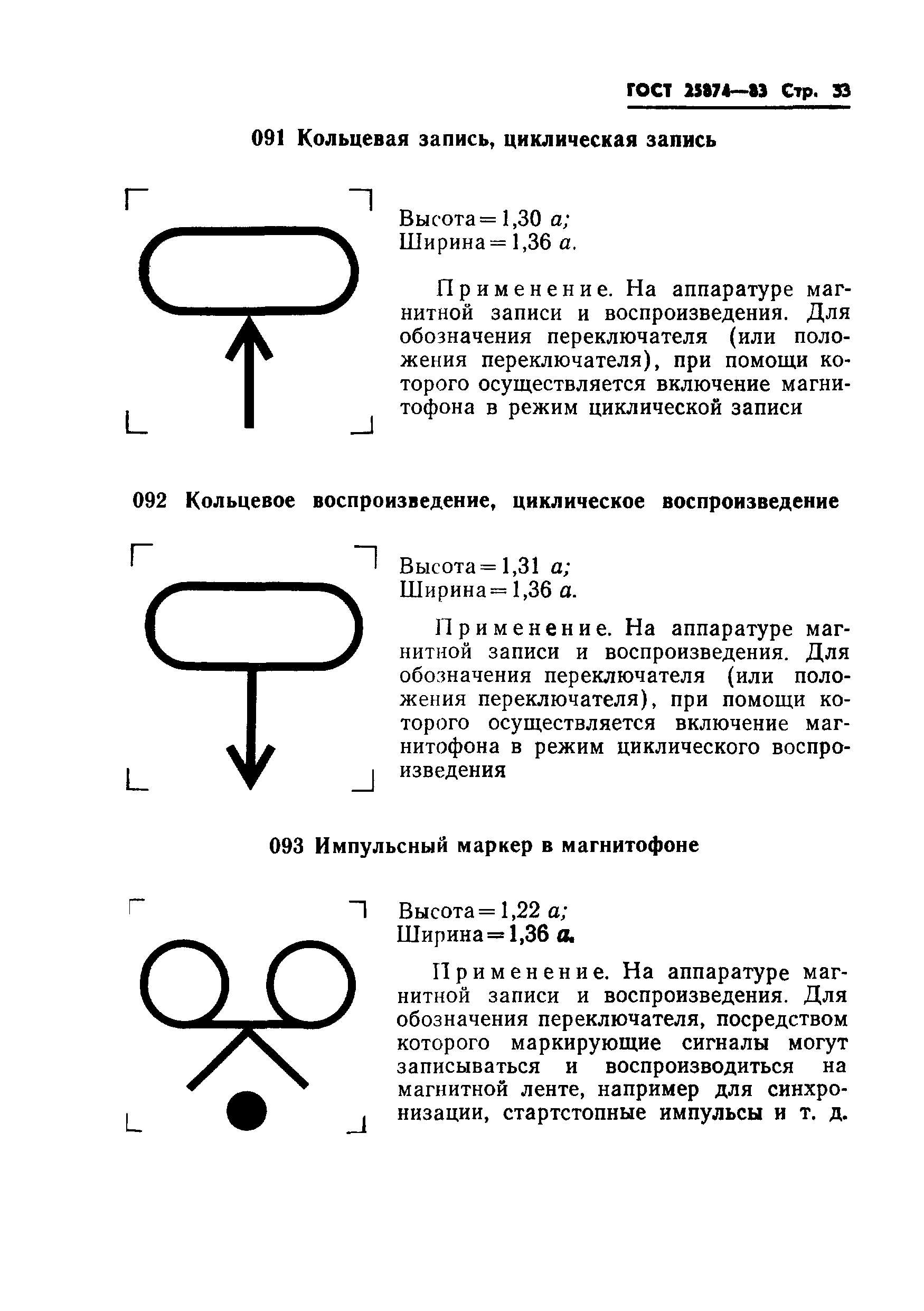
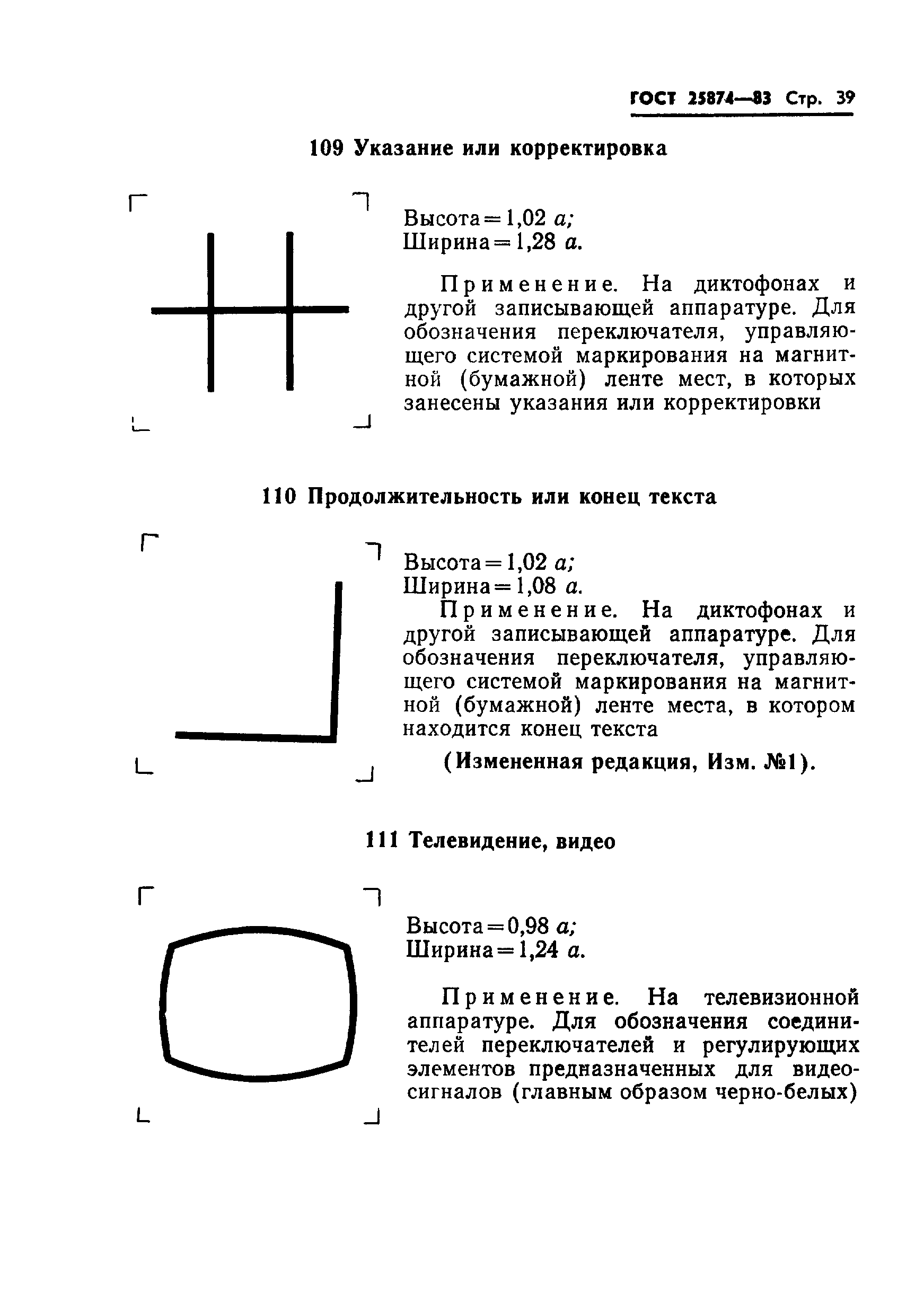
|
Генератор гармоник: высота = 1,04 ; ширина = 1,04 . | ||
|
Применяется на аппаратуре связи для обозначения преобразователя, генерирующего частоты гармоник из основной частоты. | |||
|
Примечание. может заменяться конкретным значением этой частоты, например 4 кГц | |||
|
|
Автоматический переключатель: высота = 1,34 ; ширина = 1,34 . | ||
|
Применяется на аппаратуре связи для обозначения автоматического переключателя | |||
|
015 |
Ручной переключатель: высота = 1,04 ; ширина = 1,04 . | ||
|
Применяется на аппаратуре связи для обозначения ручного переключателя | |||
|
|
016 |
Корректор искажений: высота = 1,04 ; ширина = 1,04 . | |
|
Применяется на аппаратуре связи для обозначения корректора искажений. | |||
|
Примечание. Для уточнения функции в обозначение могут вводиться символы: — амплитудно-частотное искажение; — фазо-частотное искажение; — искажение, обусловленное временем пробега | |||
|
017 |
Шлейф: высота = 1,09 ; ширина = 0,8 . | ||
|
Применяется на аппаратуре связи для обозначения устройства образования шлейфа линии передачи | |||
|
018 |
Демодулятор: высота = 0,96 ; ширина = 1,3 . | ||
|
| |||
|
|
Примечание. В телефонии на несущей частоте категория демодулятора может указываться путем внесения штрихов в левый верхний угол обозначения, как это показано на примерах: — первичная группа | ||
|
019 |
Модулятор: высота = 0,96 ; ширина = 1,3 . | ||
|
Применяется на аппаратуре связи для обозначения устройства, в котором осуществляется модуляция несущей частоты. | |||
|
Примечание. — первичная группа — вторичная группа | |||
|
020 |
Модем: высота = 0,96 ; ширина = 1,3 . | ||
|
Применяется на аппаратуре связи для обозначения модулятора-демодулятора | |||
|
021 |
Фазовый джиттер: высота = 0,6 ; ширина = 1,2 . | ||
|
Применяется на аппаратуре связи для обозначения устройства измерения фазового джиттера | |||
|
022 |
Фильтр фазового джиттера: высота = 0,6 ; ширина = 1,2 . | ||
|
Применяется на аппаратуре связи для обозначения фильтра фазового джиттера | |||
|
023 |
Сигнал двухуровневый: высота = 0,5 ; ширина = 0,75 . | ||
|
Применяется при цифровой передаче для обозначения двухуровневого сигнала (например двоичного сигнала) | |||
|
024 |
Сигнал трехуровневый: высота = 1,2 ; ширина = 1 . | ||
|
Применяется при цифровой передаче для обозначения трехуровневого сигнала (например биполярного сигнала) | |||
|
025 |
Сигнал, кодированный двоичным кодом: высота = 0,25 ; ширина = 1,5 . | ||
|
Применяется при цифровой передаче для обозначения сигнала, кодированного двоичным кодом (например в импульсно-кодовой модуляции (ИКМ) | |||
|
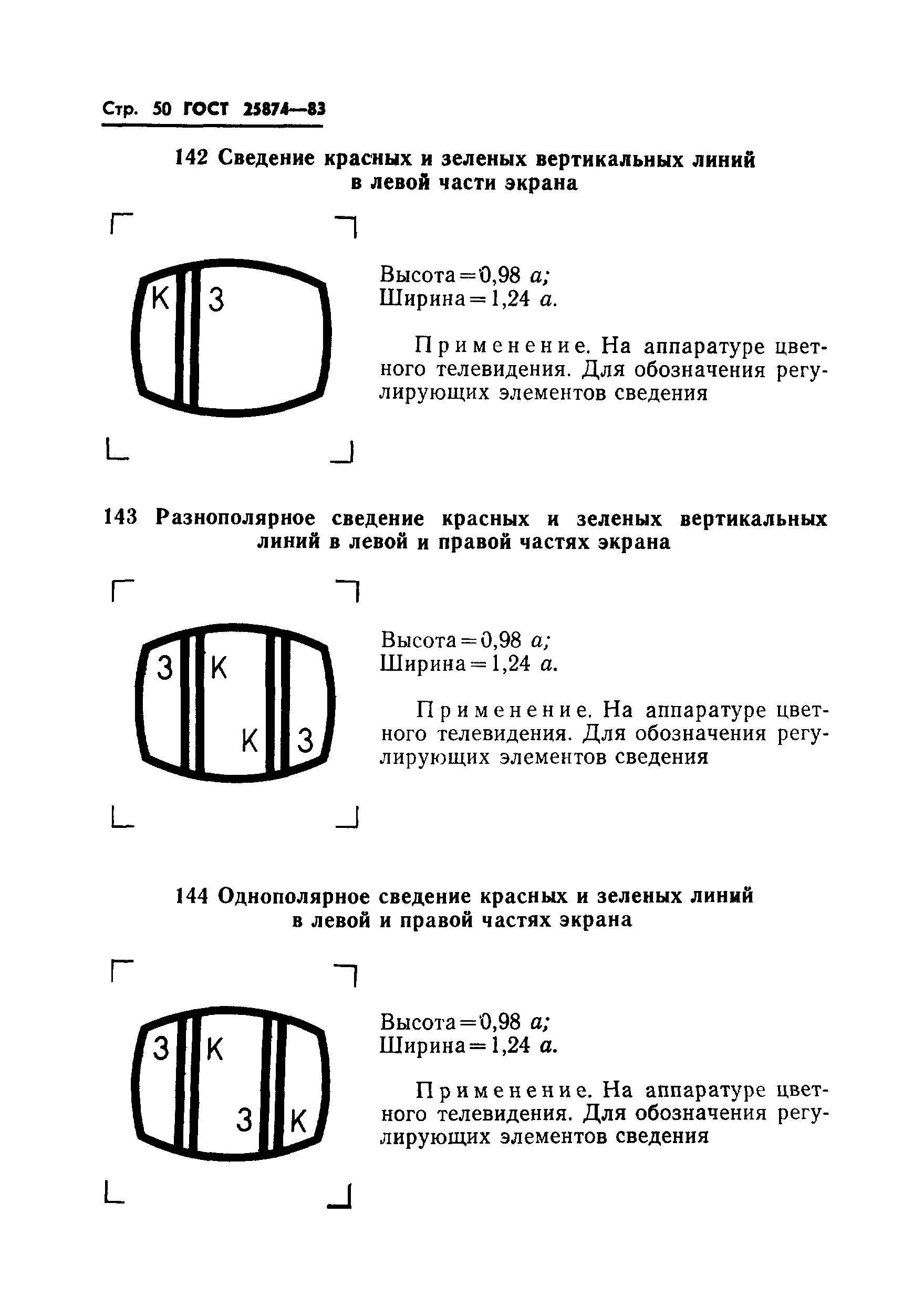
026 |
Цикл при цифровой передаче: высота = 0,5 ; ширина = 1 . | ||
|
Применяется при цифровой передаче для обозначения импульсов, включенных в один цикл | |||
|
027 |
Многократный цикл при цифровой передаче: высота = 0,5 ; ширина = 1 . | ||
|
Применяется при цифровой передаче для обозначения импульсных циклов, включенных в один многократный цикл | |||
|
028 |
Синхронизация по циклу при цифровой передаче: высота = 0,75 ; ширина = 1 . | ||
|
Применяется при цифровой передаче для обозначения синхронизации по циклу | |||
|
029 |
Потеря синхронизации по циклу при цифровой передаче: высота = 0,75 ; ширина = 1 . | ||
|
Применяется при цифровой передаче для обозначения потери синхронизации по циклу | |||
|
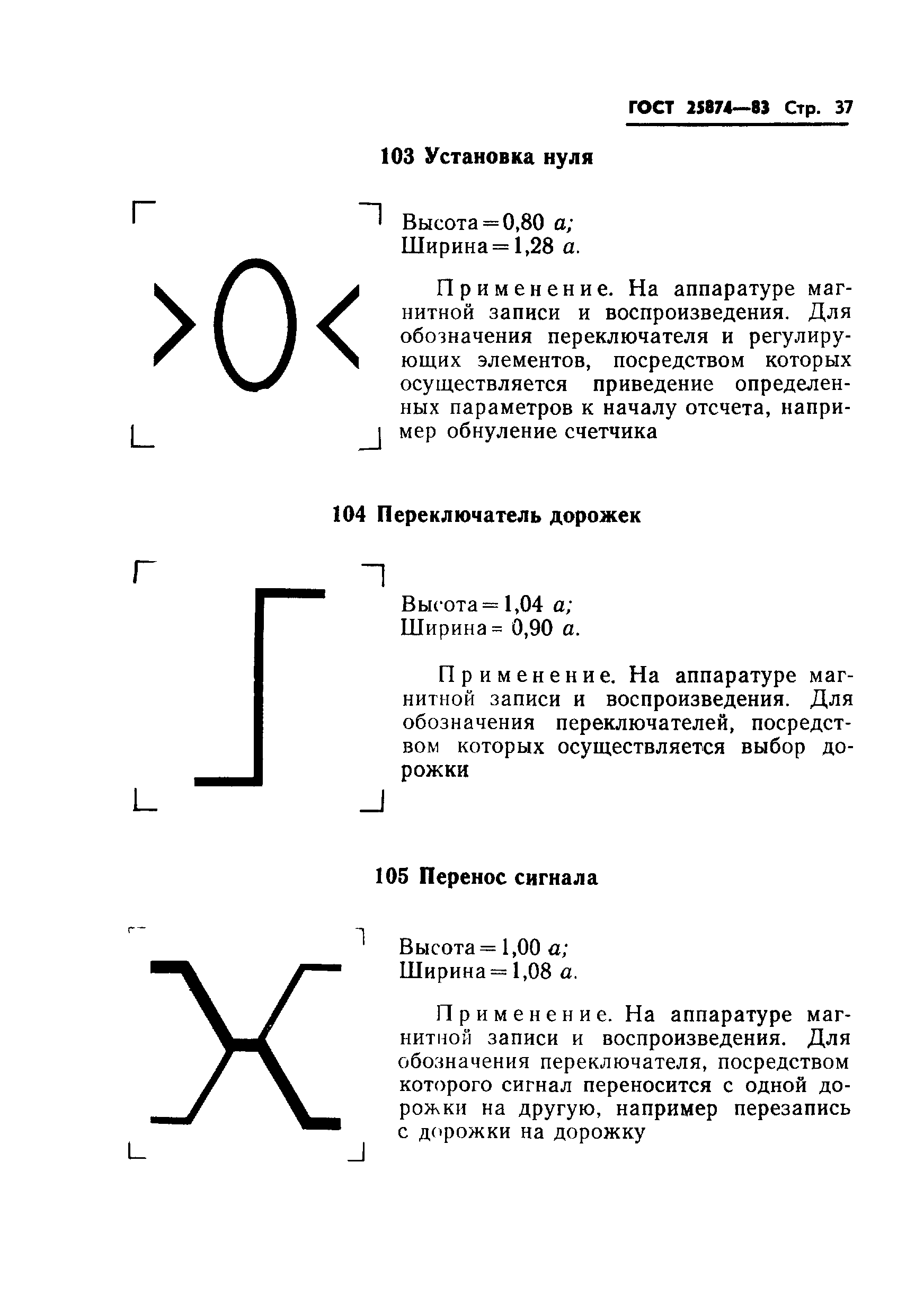
030 |
Ошибка сигнала синхронизации по циклу при цифровой передаче: высота = 0,5 ; ширина = 1 . | ||
|
Применяется при цифровой передаче для обозначения ошибки сигнала синхронизации по циклу | |||
|
031 |
Регенератор: высота = 1,04 ; ширина = 1,04 . | ||
|
Применяется на приборе, выполняющем регенерацию цифровых сигналов вместе с дополнительными функциями | |||
|
032 |
Цифровой соединитель: высота = 1,04 ; ширина = 1,04 . | ||
|
Применяется на цифровых передающих устройствах для обозначения цифрового соединителя | |||
|
Примечание. Символ может дополняться обозначениями скоростей передачи на входе и выходе | |||
|
033 |
Цифровой сепаратор: высота = 1,04 ; ширина = 1,04 . | ||
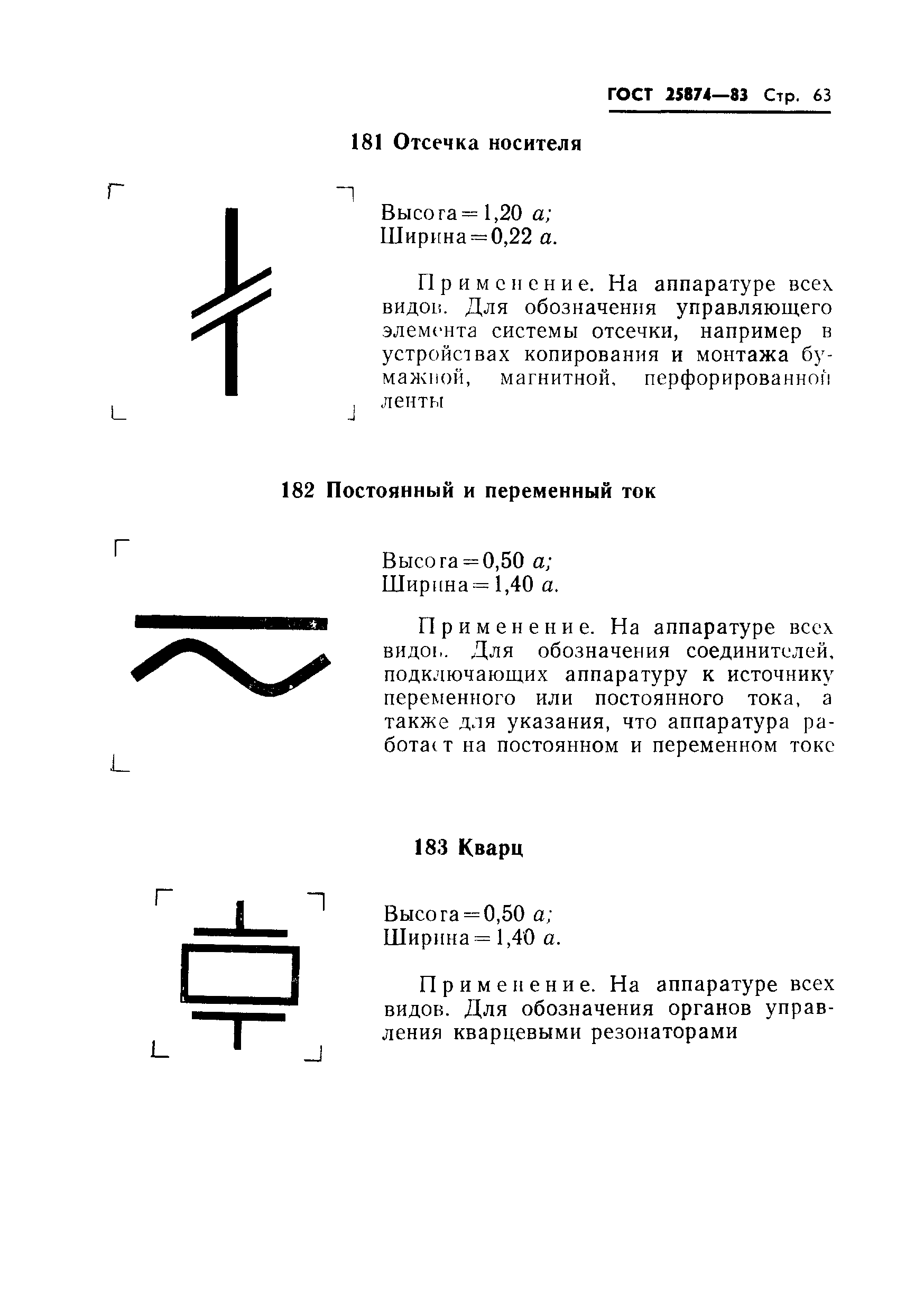
|
Применяется на цифровых передающих устройствах для обозначения цифрового сепаратора. | |||
|
Примечание. Символ может дополняться обозначениями скоростей передачи на входе и выходе | |||
|
034 |
Радиолокационный контроль излучаемой мощности: высота = 0,92 ; ширина = 1,3 . | ||
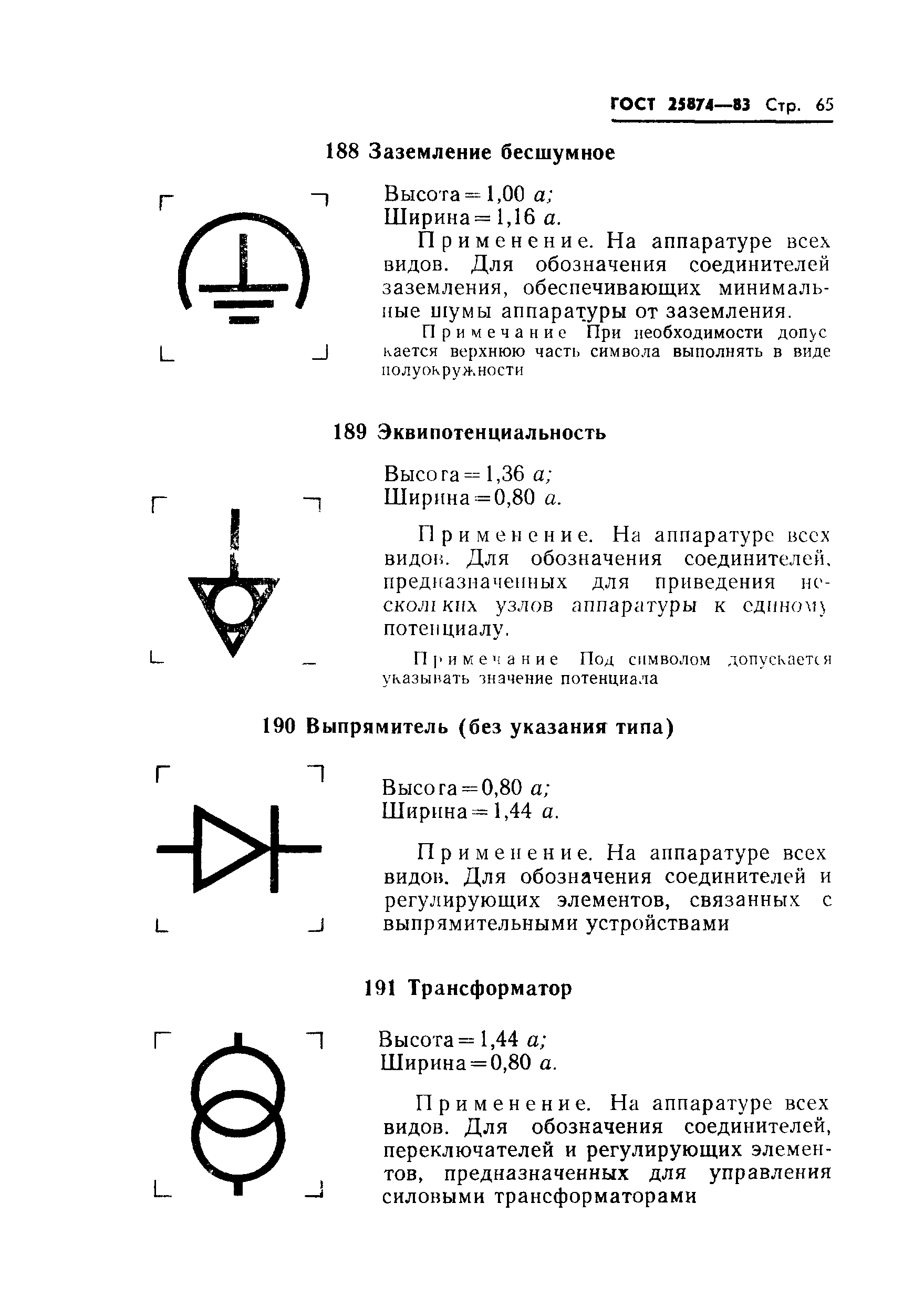
|
Применяется на пультах управления РЛС, используемых, главным образом, в морской навигации для обозначения положения выключателя «Включено» прибора контроля излучаемой мощности | |||
|
035 |
Радиолокационный контроль передачи-приема: высота = 0,92 ; ширина = 1,3 . | ||
|
Применяется на пультах управления РЛС, используемых, главным образом, в морской навигации для обозначения положения выключателя «Включено» монитора передачи-приема | |||
|
036 |
Поворот радиолокационной антенны: высота = 0,8 ; ширина = 1,3 . | ||
|
Применяется на пультах управления РЛС, используемых, главным образом, в морской навигации для обозначения переключателя поворота антенны | |||
|
|
037 |
Радиолокационный импульс короткий: высота = 1,16 ; ширина = 1,22 . | |
|
Применяется на пультах управления РЛС, используемых, главным образом, в морской навигации для обозначения положения короткого импульса широтно-импульсного переключателя | |||
|
038 |
Радиолокационный импульс длинный: высота = 0,92 ; ширина = 1,3 . | ||
|
Применяется на пультах управления РЛС, используемых, главным образом, в морской навигации для обозначения положения длинного импульса широтно-импульсного переключателя | |||
|
039 |
Радиопеленгатор бортовой: высота = 1,16 ; ширина = 1,16 . | ||
|
Применяется на пультах управления РЛС, используемых, главным образом, в морской навигации для обозначения переключателя или регулятора ориентировки бортового радиопеленгатора | |||
|
040 |
Переключатель диапазона дальности: высота= 1,16 ; ширина = 1,16 . | ||
|
Применяется на пультах управления РЛС, используемых, главным образом, в морской навигации для обозначения переключателя выбора диапазона дальности | |||
|
041 |
Штриховая отметка пеленгатора: высота = 1,16 ; ширина = 1,16 . | ||
|
Применяется на пультах управления РЛС, используемых, главным образом, в морской навигации для обозначения регулятора штриховых отметок пеленгатора | |||
|
042 |
Режим работы «Ориентация Курс»: высота = 1,16 ; ширина = 1,16 . | ||
|
Применяется на пультах управления РЛС, используемых, главным образом, в морской навигации для обозначения положения переключателя режимов работы «Ориентация Курс» | |||
|
043 |
Режим работы «Ориентация по меридиану»: высота = 1,34 ; ширина = 1,16 . | ||
|
Применяется на пультах управления РЛС, используемых, главным образом, в морской навигации для обозначения положения переключателя режимов работы «Ориентация по меридиану» | |||
|
|
044 |
Яркость круговой шкалы дальности: высота = 1,16 ; ширина = 1,16 . | |
|
Применяется на пультах управления РЛС, используемых, главным образом, в морской навигации для обозначения максимального положения регулятора яркости круговой шкалы дальности | |||
|
045 |
Изменяемая калибровка по дальности: высота = 1,16 ; ширина = 1,16 . | ||
|
Применяется на пультах управления РЛС, используемых, главным образом, в морской навигации для обозначения регулятора изменяемой калибровки по дальности | |||
|
046 |
Подавление отражения волн минимальное: высота = 1,16 ; ширина = 1,16 . | ||
|
Применяется на пультах управления РЛС, используемых, главным образом, в морской навигации для обозначения минимального положения регулятора затухания волн | |||
|
047 |
Подавление отражения волн максимальное: высота = 1,16 ; ширина = 1,16 . | ||
|
Применяется на пультах управления РЛС, используемых, главным образом, в морской навигации для обозначения максимального положения регулятора затухания волн | |||
|
048 |
Подавление отражения «дождя» минимальное: высота = 1,16 ; ширина = 1,16 . | ||
|
Применяется на пультах управления РЛС, используемых, главным образом, в морской навигации для обозначения минимального положения регулятора подавления отражения «дождя» | |||
|
049 |
Подавление отражения «дождя» максимальное: высота = 1,16 ; ширина = 1,16 . | ||
|
Применяется на пультах управления РЛС, используемых, главным образом, в морской навигации для обозначения максимального положения регулятора подавления отражения «дождя» | |||
|
050 |
Ключ Морзе: высота = 0,96 ; ширина = 1,3 . | ||
|
Применяется на устройствах техники связи для обозначения присоединительных элементов или органов регулировки ключа Морзе | |||
|
051 |
Графический самописец: высота = 1,12 ; ширина = 1,12 . | ||
|
Применяется на всех видах аппаратуры для обозначения органов управления, относящихся к графическому самописцу | |||
|
052 |
Печатающее устройство: высота = 1,04 ; ширина = 1,04 . | ||
|
Применяется на всех видах аппаратуры для обозначения органов управления, относящихся к печатающему устройству | |||
|
053 |
Гидрофон: высота = 0,8 ; ширина = 1,42 . | ||
|
Применяется на гидроакустических приборах для обозначения присоединительных элементов и органов регулировки гидрофона | |||
|
054 |
Гидроакустический излучатель: высота = 0,8 ; ширина = 1,42 . | ||
|
Применяется на гидроакустических приборах для обозначения вводов и элементов регулировки гидроакустического излучателя | |||
|
055 |
Обратимый гидроакустический преобразователь: высота = 0,8 ; ширина = 1,42 . | ||
|
Применяется на гидроакустических приборах для обозначения вводов и элементов регулировки гидроакустического излучателя | |||
|
056 |
Гироиндикатор: высота = 1,33 ; ширина = 1,16 . | ||
|
Применяется на радиопеленгаторах, используемых, главным образом, в морской навигации для обозначения гироиндикатора | |||
|
057 |
Установка гироиндикатора: высота = 1,33 ; ширина = 1,16 . | ||
|
Применяется на радиопеленгаторах, используемых, главным образом, в морской навигации для обозначения установки гироиндикатора | |||
|
058 |
Истинный пеленг по гирокомпасу: высота = 1,33 ; ширина = 1,16 . | ||
|
Применяется на радиопеленгаторах, используемых, главным образом, в морской навигации для обозначения ручки управления истинным пеленгом по гирокомпасу | |||
|
059 |
Относительный пеленг: высота = 1,16 ; ширина = 1,16 . | ||
|
Применяется на радиопеленгаторах, используемых, главным образом, в морской навигации для обозначения ручки управления относительным пеленгом | |||
|
060 |
Установка пеленга: высота = 1,16 ; ширина = 1,16 . | ||
|
Применяется на радиопеленгаторах, используемых, главным образом, в морской навигации для обозначения ручки установки пеленга | |||
|
061 |
Градуировка по фазе: высота = 1,16 ; ширина = 1,16 . | ||
|
Применяется на радиопеленгаторах, используемых, главным образом, в морской навигации для обозначения ручки управления градуировкой по фазе | |||
|
062 |
Градуировка по углу: высота = 1,16 ; ширина = 1,16 . | ||
|
Применяется на радиопеленгаторах, используемых, главным образом, в морской навигации для обозначения ручки управления градуировкой по углу | |||
|
063 |
Переключатель антенны радиокомпаса: высота = 1,32 ; ширина = 0,54 . | ||
|
Применяется на радиопеленгаторах, используемых, главным образом, в морской навигации для обозначения переключателя антенны радиокомпаса | |||
|
064 |
Местный сигнал: высота = 0,5 ; ширина = 1,3 . | ||
|
Применяется на аппаратуре связи для обозначения внутренних сигналов системы или аппаратуры | |||
|
065 |
Дистанционный сигнал: высота = 0,5 ; ширина = 1,3 . | ||
|
Применяется на аппаратуре связи для обозначения внутренних сигналов системы или аппаратуры | |||
|
066 |
Шифратор: высота = 1,15 ; ширина = 1,04 . | ||
|
Применяется на аппаратуре связи для обозначения шифраторов | |||
|
067 |
Дешифратор: высота = 1,15 ; ширина = 1,04 . | ||
|
Применяется на аппаратуре связи для обозначения дешифраторов | |||
Почему кнопка записи красная и круглая?
Почему кнопка записи красная и круглая?
Красный цвет использовался в теле- и радиовещании всегда — радиостанции применяли красный знак «ON AIR», видеокамеры светились красным ярким огоньком. Такая индикация предупреждала людей о том, что происходит нечто важное, чему нельзя мешать. Несмотря на это, кнопка записи не всегда обозначалась красным кругом — такую форму привычная нам клавиша REC приобрела чуть более 45 лет назад.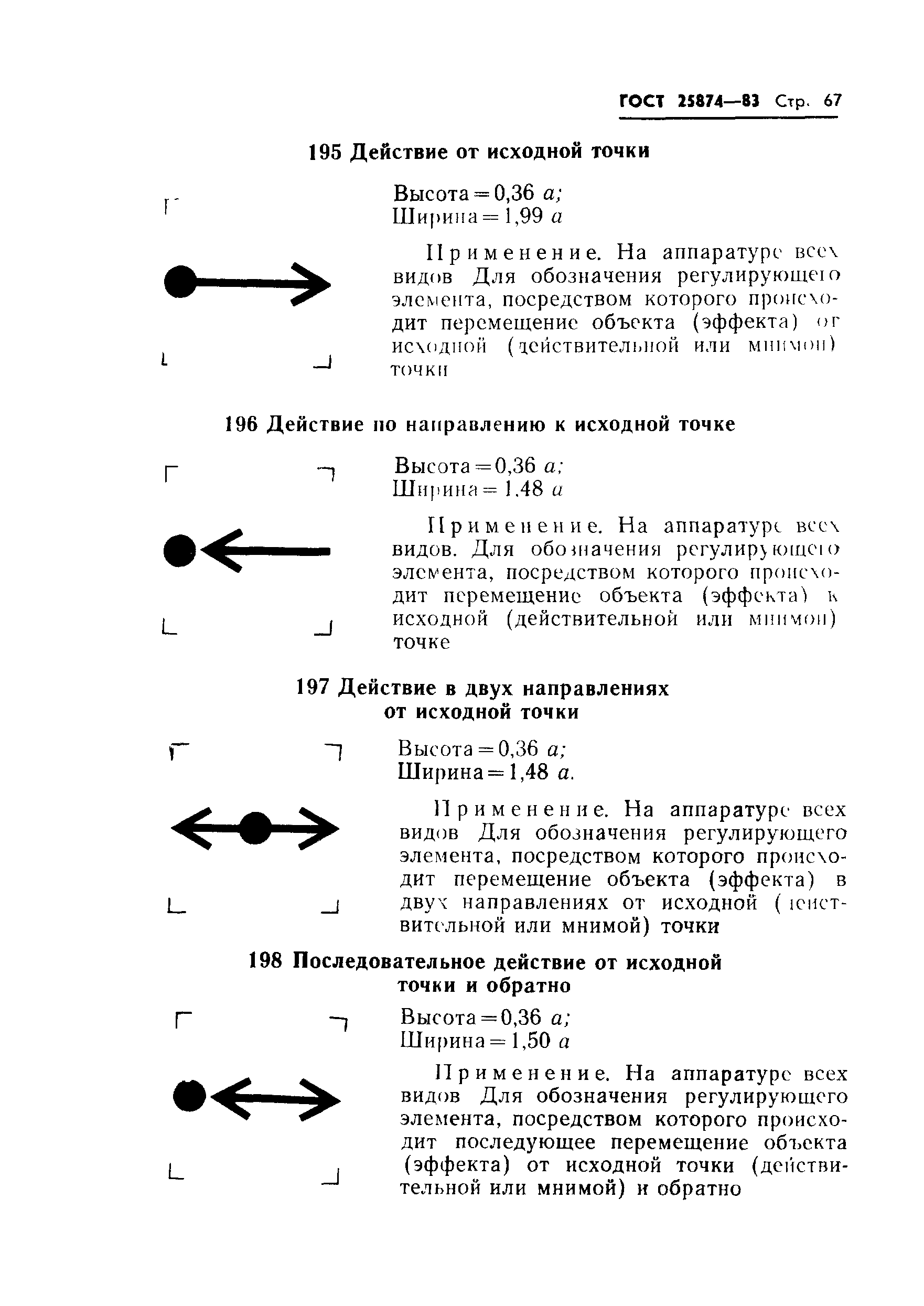
До 1973 года производители отмечали функцию звукозаписи разными символами. При всей своей пользе, производители старались сделать как можно более незаметной функцию записи звука. Причина таких пряток простая: фирмы опасались случайного затирания плёнок слушателями и, как следствие, каких-либо претензий со стороны пользователей. К примеру, на швейцарском магнитофоне Revox C36 (Studer-Revox C36), выпущенном в 1958-1959 годах, функция записи отмечена тремя волнистыми линиями. В тот же самый момент на американском магнитофоне Brenell тех же времён за воспроизведение и запись отвечала кнопка красного цвета. Для переключения между воспроизведением и записью нужно было щёлкнуть специальный переключатель на корпусе магнитофона.
Одним из первых устройств с красной кнопкой REC стал компактный магнитофон Norelco Carry-Corder 150, вышедший в 1964 году. Устройство создавалось с прицелом на часто берущих интервью журналистов и отличалось простотой работы. Чтобы упростить доступ к звукозаписи, инженеры и дизайнеры компании поместили кнопку записи на самое видное место на корпусе, сделали её крупнее и покрасили в красный цвет. Постепенно такое дизайнерское решение переняли и другие производители аудиотехники.
Постепенно такое дизайнерское решение переняли и другие производители аудиотехники.
Круглая красная иконка звукозаписи появилась несколько позднее. В 1973 году Международная электротехническая комиссия (IEC) приняла стандарт IEC 417 — «Графические символы для использования в оборудовании» (ISO 7000 / IEC 60417). Стандарт закреплял иконки и символы для большинства существующего тогда электрооборудования и функций, выполняемых им. Звукозапись была одной из кнопок, чьё графическое обозначение было стандартизировано IEC 417. Так как символы треугольника, прямоугольника и квадрата давно использовались и обозначали воспроизведение, паузу и полную остановку, функцию звукозаписи обозначили кругом.
В стандарте также отмечалось, что если производитель не может обозначить звукозапись красным кругом, он обязан выделить кнопку REC красным цветом, чтобы избежать у пользователей путаницы с другими клавишами управления аппаратурой. Внедрение стандарта привело к тому, что вся аудио- и видеоаппаратура обзавелась либо полностью красными кнопками, либо чёрными кнопками с красным кругом.
В СССР и России условные обозначений функций звукозаписи и воспроизведения закреплены в ГОСТ 25874-83 «Аппаратура радиоэлектронная, электронная и электротехническая. Условные функциональные обозначения», который действует с 1984 года. ГОСТ во многом основан на международном стандарте IEC 417, поэтому кнопка записи у нас также обозначается красным кругом.
Электро-комплектующие изделия
Манипуляционные знаки
Маркировка параметров и характеристик электрооборудования должна быть нанесена на электрооборудование соответствующим методом, например на табличку с паспортными данными, бирку или этикетку. Маркировка должна быть четкой, видимой, прочной и сохраняться в течение ожидаемого срока эксплуатации электрооборудования. Маркировка не должна наноситься на съемные части, кроме части кожуха, которую снимают для установки электрооборудования с последующим возвращением на место. Для некоторого электрооборудования требуется маркировка входных и выходных параметров и характеристик. В таких случаях в стандартах и технических условиях на электрооборудование конкретных видов должны устанавливаться требования по маркировке для выходных и входных параметров и характеристик. Некоторое электрооборудование может быть предназначено для использования при нескольких значениях напряжения или частоты источника питания. Может возникнуть необходимость в том, чтобы пользователь внес изменения в электрооборудование для использования его с источником питания с заданным номинальным напряжением. Некоторое оборудование предназначено для использования при нескольких номинальных напряжениях или в диапазоне напряжений без внесения каких-либо изменений. Во всех указанных случаях электрооборудование должно иметь соответствующую маркировку. Маркировка электрооборудования должна быть однозначной и удовлетворять правилам подготовки документов, используемых в электротехнике, в соответствии с МЭК 1082–1. Маркировка параметров должна быть выполнена с использованием стандартных сокращений согласно МЭК 445 [4] или стандартных графических символов согласно ГОСТ 25874, ГОСТ 28312, МЭК 617-2 или ИСО 7000.
В таких случаях в стандартах и технических условиях на электрооборудование конкретных видов должны устанавливаться требования по маркировке для выходных и входных параметров и характеристик. Некоторое электрооборудование может быть предназначено для использования при нескольких значениях напряжения или частоты источника питания. Может возникнуть необходимость в том, чтобы пользователь внес изменения в электрооборудование для использования его с источником питания с заданным номинальным напряжением. Некоторое оборудование предназначено для использования при нескольких номинальных напряжениях или в диапазоне напряжений без внесения каких-либо изменений. Во всех указанных случаях электрооборудование должно иметь соответствующую маркировку. Маркировка электрооборудования должна быть однозначной и удовлетворять правилам подготовки документов, используемых в электротехнике, в соответствии с МЭК 1082–1. Маркировка параметров должна быть выполнена с использованием стандартных сокращений согласно МЭК 445 [4] или стандартных графических символов согласно ГОСТ 25874, ГОСТ 28312, МЭК 617-2 или ИСО 7000.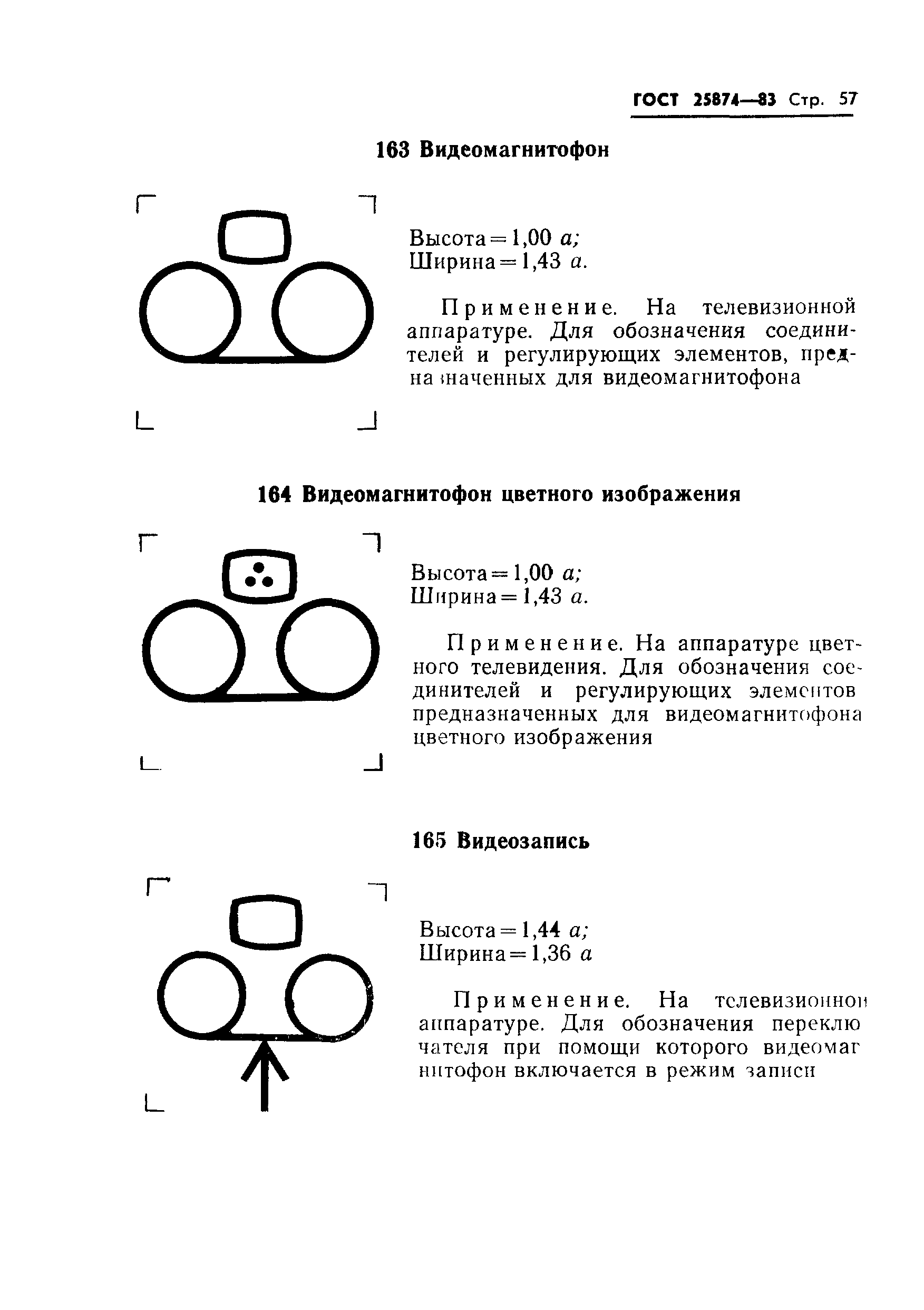 Физические величины должны быть обозначены с использованием только числовых значений и их десятичных кратных и дольных единиц, с указанием обозначений единиц измерения, как определено в МЭК 27, ИСО 31–0 и ИСО 1000. Размеры и допуски должны быть представлены однозначным способом.
Физические величины должны быть обозначены с использованием только числовых значений и их десятичных кратных и дольных единиц, с указанием обозначений единиц измерения, как определено в МЭК 27, ИСО 31–0 и ИСО 1000. Размеры и допуски должны быть представлены однозначным способом.
Предварительное исследование нового диагностического инструмента
Гены (Базель). 2020 июнь; 11(6): 693.
Андреа Онетти Муда
3 Отделение лабораторий, Детская больница Бамбино Джезу IRCCS, Piazza Sant’Onofrio 4, 00165 Рим, Италия; ten.gbpo@adumitteno.aerdna
Lorenza Putignani
4 Отделение паразитологии и микробиома человека, Детская больница Bambino Gesù IRCCS, Piazza Sant’Onofrio 4, 00165 Rome, Italy
3 Больница IRCCS, Piazza Sant’Onofrio 4, 00165 Рим, Италия; десять.gbpo@adumitteno.aerdna4 Отделения паразитологии и микробиома человека, Детская больница Бамбино Джезу IRCCS, Piazza Sant’Onofrio 4, 00165 Рим, Италия
Поступила в редакцию 30 мая 2020 г.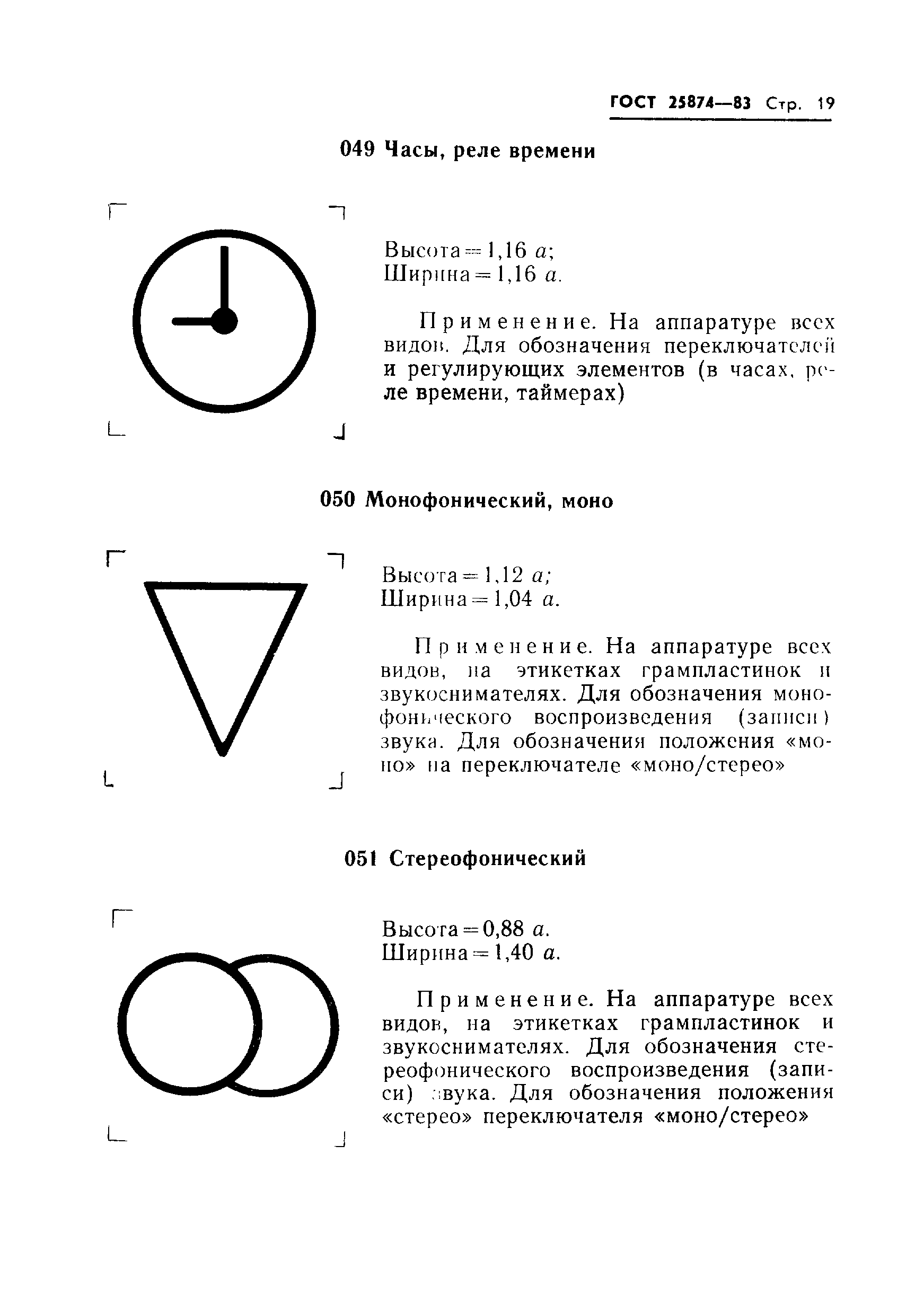 ; Принято 22 июня 2020 г.
; Принято 22 июня 2020 г.
Abstract
Анисакиоз в настоящее время является хорошо известной инфекцией, в основном вызываемой случайным проглатыванием личинок Anisakis после употребления в пищу сырой или недоваренной рыбы и головоногих моллюсков.Из-за схожести симптомов с обычными желудочно-кишечными расстройствами эту инфекцию часто недооценивают, и потребность в новых специфических диагностических инструментах становится решающей. Учитывая замечательное влияние биотипирования MALDI-TOF MS за последнее десятилетие на рутинную клиническую практику для распознавания штаммов бактерий и грибов, можно было бы предвидеть аналогичный сценарий для идентификации паразитов, таких как нематоды. В этой работе было проведено профилирование MALDI-TOF MS протеома Anisakis с целью создания первой спектральной библиотеки для диагностики инфекций Anisakis . В то же время для двух основных фракций, полученных в результате экстракции белка, был применен подход протеомики дробовика с помощью LC-ESI-MS/MS для оценки белковых видов, обогащенных протоколом. Набор сигналов MALDI-TOF MS, связанных с белками, происходящими из рибосомной фракции экстракта нематод, был выбран в качестве потенциального диагностического инструмента для идентификации Anisakis spp.
В то же время для двух основных фракций, полученных в результате экстракции белка, был применен подход протеомики дробовика с помощью LC-ESI-MS/MS для оценки белковых видов, обогащенных протоколом. Набор сигналов MALDI-TOF MS, связанных с белками, происходящими из рибосомной фракции экстракта нематод, был выбран в качестве потенциального диагностического инструмента для идентификации Anisakis spp.
Ключевые слова: анизакиоз, Anisakis spp., протеомика, MALDI–TOF MS, LC–ESI–MS/MS
1.Введение
Среди пищевых биологических опасностей особую опасность для здоровья человека представляют паразиты. Глобализация заметно увеличила изменения в привычках питания, включая широкое потребление сырой, маринованной или копченой рыбы. Более того, доля пищевых аллергий неизвестного происхождения среди населения в целом может быть связана с сенсибилизацией к Anisakis spp. (круглые черви), представляющие проблему общественного здравоохранения, клинические проявления которых характеризуются расстройствами пищеварения, астмой, дерматитами и даже анафилаксией. Нематоды семейства Anisakidae — паразиты рыб, встречающиеся по всему миру. Личинки обитают в кишечнике, висцеральной брюшине и мясе многих видов морских рыб и головоногих и могут колонизироваться через различные трофические мосты, обеспечивая и расширяя жизненный цикл паразита.
Нематоды семейства Anisakidae — паразиты рыб, встречающиеся по всему миру. Личинки обитают в кишечнике, висцеральной брюшине и мясе многих видов морских рыб и головоногих и могут колонизироваться через различные трофические мосты, обеспечивая и расширяя жизненный цикл паразита.
Люди могут стать случайными хозяевами паразита Anisakis , поедая паразитированную сырую или недоваренную рыбу, содержащую личинки на стадии 3 [1,2]. В течение нескольких часов после проглатывания личинок Anisakis проникают в слои слизистой оболочки желудочно-кишечного тракта, вызывая прямое повреждение тканей, которое может привести к зоонозному заболеванию, известному как анисакиоз.Эта острая желудочно-кишечная форма инфекции Anisakis обычно носит транзиторный характер, при этом червь погибает в течение нескольких недель. Он проявляется клиническими симптомами в диапазоне от тошноты до рвоты, диареи, болей в животе от легкой до сильной и кишечной непроходимостью [3], имитируя другие распространенные желудочно-кишечные расстройства, такие как острый аппендицит, язва желудка или опухоли, что позволяет поставить диагноз анизакиоза. чрезвычайно сложно. Диагноз обычно ставится на основании анамнестических данных, эндоскопии, рентгенографии, определения сывороточных специфических анти- Anisakis IgE или хирургического вмешательства, если червь внедрился.Окончательной оценкой является визуализация и морфологическая идентификация личинки (е), удаленной с помощью эндоскопии или хирургического вмешательства или выделяемой при кашле пациентов. На сегодняшний день не установлены однозначные диагностические критерии и лабораторный алгоритм; отсутствие высококвалифицированных микроскопистов в биомедицинских лабораториях и большое количество ложноположительных результатов из-за перекрестной реактивности с многочисленными паналлергенами подчеркнули необходимость улучшения диагностических подходов. Действительно, из-за технических трудностей в их диагностике эти инфекции, вероятно, будут недодиагностированы.
чрезвычайно сложно. Диагноз обычно ставится на основании анамнестических данных, эндоскопии, рентгенографии, определения сывороточных специфических анти- Anisakis IgE или хирургического вмешательства, если червь внедрился.Окончательной оценкой является визуализация и морфологическая идентификация личинки (е), удаленной с помощью эндоскопии или хирургического вмешательства или выделяемой при кашле пациентов. На сегодняшний день не установлены однозначные диагностические критерии и лабораторный алгоритм; отсутствие высококвалифицированных микроскопистов в биомедицинских лабораториях и большое количество ложноположительных результатов из-за перекрестной реактивности с многочисленными паналлергенами подчеркнули необходимость улучшения диагностических подходов. Действительно, из-за технических трудностей в их диагностике эти инфекции, вероятно, будут недодиагностированы.
В настоящее время масс-спектрометрическое (МС) биотипирование является быстрым, простым и проверенным методом точной микробной фенотипической идентификации (ИД). Он использует преимущества технологии времяпролетной МС с лазерной десорбцией/ионизацией с использованием матрицы (MALDI-TOF MS). В частности, три платформы, т. е. MALDI Biotyper (Bruker Daltonics GmbH, Бремен, Германия), VITEK MS (bioMerieux, Марси-л’Этуаль, Франция) и Andromas MS (Париж, Франция), в настоящее время одобрены для рутинного использования и приняты. многими клинико-микробиологическими лабораториями [4,5,6,7], что способствует клинической идентификации многих патогенных микроорганизмов, включая бактерии, дрожжевые и мицелиальные грибы.Однако за последние 10 лет наблюдается рост применения этой технологии, с обнадеживающими результатами также в исследованиях паразитов [8,9]. Недавнее применение MALDI-TOF MS для профилирования на основе белков Dirofilaria и Ascaris показало многообещающий сценарий для клинических приложений, связанных с биотипированием нематод [10].
Он использует преимущества технологии времяпролетной МС с лазерной десорбцией/ионизацией с использованием матрицы (MALDI-TOF MS). В частности, три платформы, т. е. MALDI Biotyper (Bruker Daltonics GmbH, Бремен, Германия), VITEK MS (bioMerieux, Марси-л’Этуаль, Франция) и Andromas MS (Париж, Франция), в настоящее время одобрены для рутинного использования и приняты. многими клинико-микробиологическими лабораториями [4,5,6,7], что способствует клинической идентификации многих патогенных микроорганизмов, включая бактерии, дрожжевые и мицелиальные грибы.Однако за последние 10 лет наблюдается рост применения этой технологии, с обнадеживающими результатами также в исследованиях паразитов [8,9]. Недавнее применение MALDI-TOF MS для профилирования на основе белков Dirofilaria и Ascaris показало многообещающий сценарий для клинических приложений, связанных с биотипированием нематод [10].
Целью данного исследования является распространение подхода MALDI-TOF MS Biotyper на Anisakis spp. ИД и определить предварительную оценку его возможностей в диагностике анизакиоза.Параллельно для двух основных фракций протокола экстракции было выполнено профилирование идентификации белков Anisakis с помощью жидкостной хроматографии-ионизации электрораспылением-тандемной МС (ЖХ-ESI-MS/MS) с целью выявления взаимосвязи с специально обнаруженные сигналы MALDI-TOF MS Biotyper.
ИД и определить предварительную оценку его возможностей в диагностике анизакиоза.Параллельно для двух основных фракций протокола экстракции было выполнено профилирование идентификации белков Anisakis с помощью жидкостной хроматографии-ионизации электрораспылением-тандемной МС (ЖХ-ESI-MS/MS) с целью выявления взаимосвязи с специально обнаруженные сигналы MALDI-TOF MS Biotyper.
2. Материалы и методы
Заражение несколькими живыми личинками паразитов, выделенными из порций лосося, купленных в местном супермаркете в Риме в конце 2019 года, оценивали с помощью макроскопического наблюдения.Дополнительно проводили микроскопический анализ с использованием микроскопа Axiovert 25 (Zeiss, Йена, Германия). Образцы были идентифицированы как Anisakis spp. личинки.
2.1. Экстракция белка
Пять особей несколько раз промывали в 0,9% растворе NaCl, и каждую личинку хранили в стерильном 0,9% растворе NaCl в соотношении 1:3 (масса паразита/объем изотонического раствора) при -80 °С .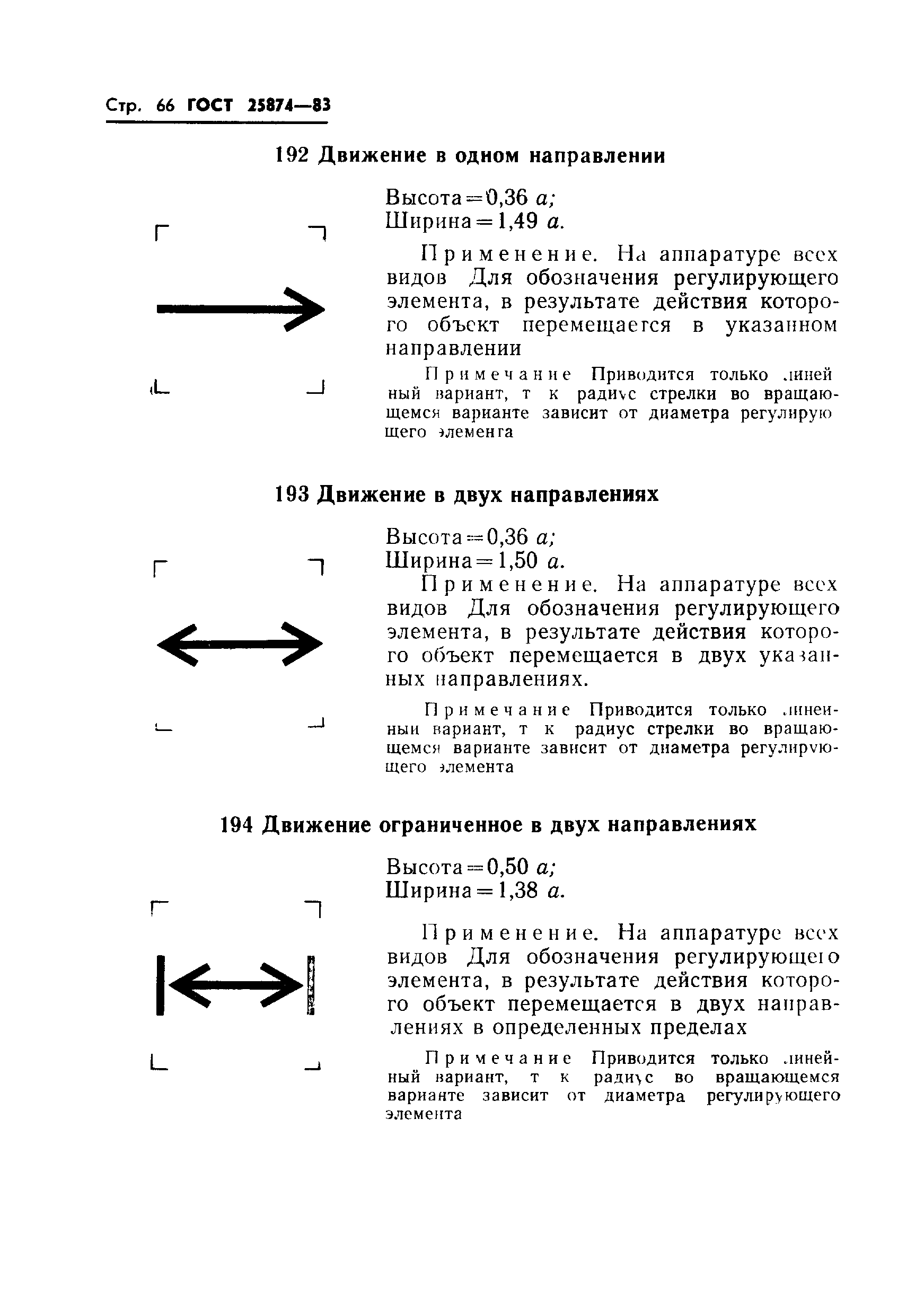 Механическую гомогенизацию замороженного материала проводили стальным пестиком с последующей обработкой биомассы ультразвуком при 100% мощности (BactoSonic, BANDELIN electronic GmbH & Co KG, Берлин, Германия) за пять циклов по 30 с.К полученному образцу добавляли 200 мкл буфера для лизиса из набора MALDI Sepsityper (Bruker Daltonics GmbH, Бремен, Германия) и перемешивали встряхиванием в течение 10 с. После центрифугирования осадок суспендировали в 1 мл промывочного буфера (набор MALDI Sepsityper Kit) и после повторного центрифугирования надосадочную жидкость («образец А») использовали для анализа ЖХ-ЭСИ-МС/МС.
Механическую гомогенизацию замороженного материала проводили стальным пестиком с последующей обработкой биомассы ультразвуком при 100% мощности (BactoSonic, BANDELIN electronic GmbH & Co KG, Берлин, Германия) за пять циклов по 30 с.К полученному образцу добавляли 200 мкл буфера для лизиса из набора MALDI Sepsityper (Bruker Daltonics GmbH, Бремен, Германия) и перемешивали встряхиванием в течение 10 с. После центрифугирования осадок суспендировали в 1 мл промывочного буфера (набор MALDI Sepsityper Kit) и после повторного центрифугирования надосадочную жидкость («образец А») использовали для анализа ЖХ-ЭСИ-МС/МС.
Наконец, полученный осадок ресуспендировали в 1,2 мл раствора вода/этанол 1:3 и 2/3 его центрифугировали, получая второй осадок («В»), который ресуспендировали в 35% муравьиной кислоте ( FA), 15% воды и 50% ацетонитрила (ACN) для анализа MALDI-TOF MS («образец B M », M как аббревиатура для MALDI-TOF MS).
Параллельно 1/3 раствора центрифугировали в течение 2 мин при 14 000 об/мин, а полученный осадок («B») обрабатывали ультразвуком (VibraCell Ultrasonic Liquid Processor, Sonics & Materials Inc, Newtown, CT, USA) 7 раз.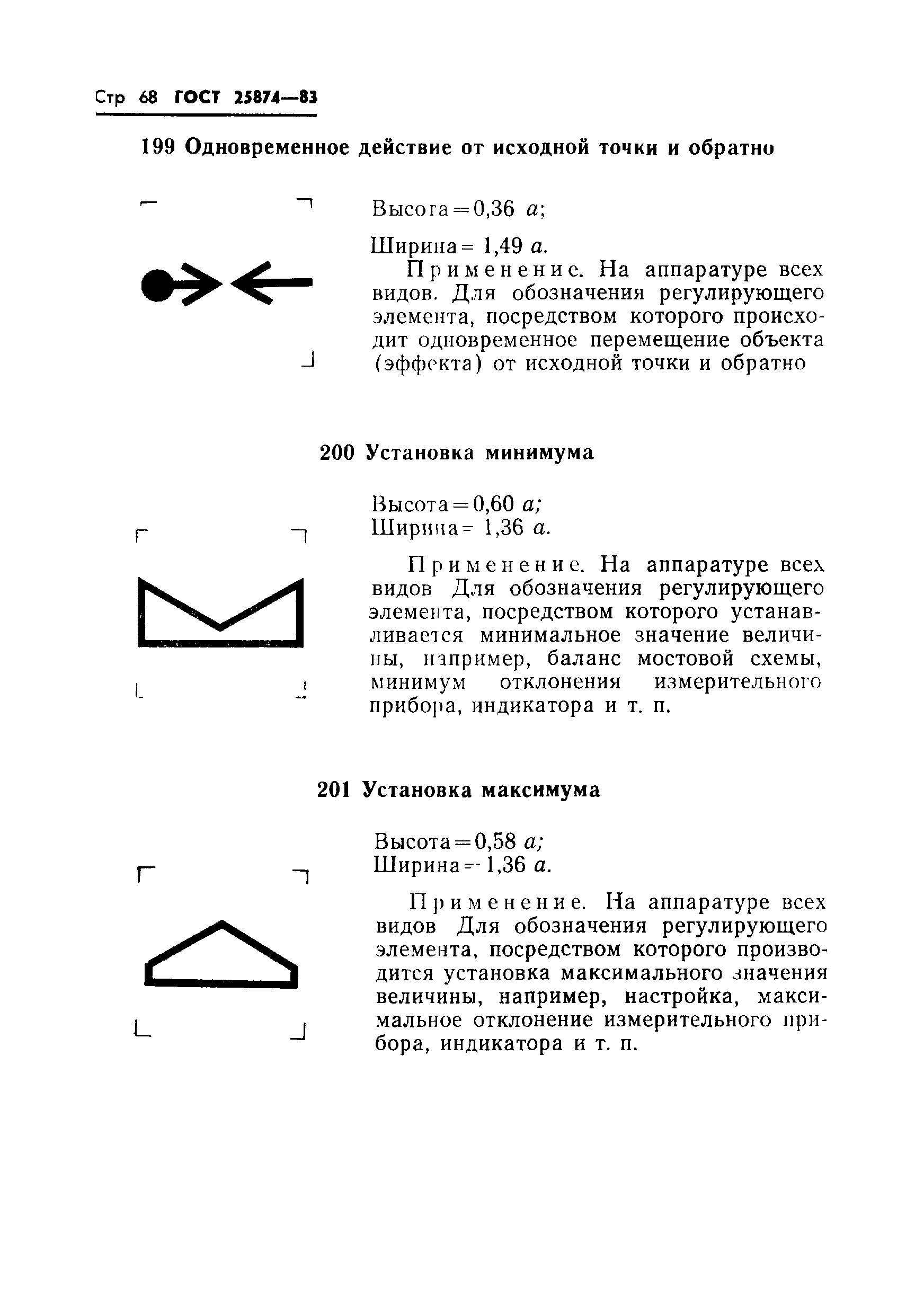 , амплитуда 60 %, в буфере для образцов (7 М мочевина, 2 М тиомочевина, 4 % гидрат 3-[(3-холамидопропил)диметиламмонио]-1-пропансульфоната (CHAPS), 40 мМ тризмы и 50 мМ дитиотреитола (ДТТ)) и инкубировали 1 ч при 37°С. После центрифугирования при 14 000 об/мин в течение 15 минут супернатант («образец B LC », ЖХ как аббревиатура от LC-ESI-MS/MS) собирали для проведения анализа LC-ESI-MS/MS () .
, амплитуда 60 %, в буфере для образцов (7 М мочевина, 2 М тиомочевина, 4 % гидрат 3-[(3-холамидопропил)диметиламмонио]-1-пропансульфоната (CHAPS), 40 мМ тризмы и 50 мМ дитиотреитола (ДТТ)) и инкубировали 1 ч при 37°С. После центрифугирования при 14 000 об/мин в течение 15 минут супернатант («образец B LC », ЖХ как аббревиатура от LC-ESI-MS/MS) собирали для проведения анализа LC-ESI-MS/MS () .
Эскиз двух протеомных экспериментальных подходов, использованных для Anisakis spp. идентификация.
2.2. Матричная лазерная десорбция/ионизация–времяпролетная масс-спектрометрия (MALDI–TOF MS)
Один микролитр образца B M помещали на полированную стальную мишень MSP 96 (Bruker Daltonics, GmbH, Бремен, Германия), воздух — высушивают и покрывают 1 мкл матрицы, состоящей из раствора 5 мг/мл α-циано-4-гидроксикоричной кислоты (Bruker Daltonics GmbH, Бремен, Германия) в 50% ACN, 47.5% воды, 2,5% трифторуксусной кислоты (TFA). Каждый образец наносили на восемь целевых точек мишени MALDI, а спектральные измерения выполняли с помощью масс-спектрометра Microflex LT (Biotyper, Bruker Daltonics GmbH, Бремен, Германия), оснащенного программным пакетом FlexControl (версия 3. 4, Bruker Daltonics). GmbH, Бремен, Германия), работающий в положительном линейном режиме (частота лазера 20 Гц, напряжение ионного источника 1 20 кВ, ионного источника 2 напряжение 18,4 кВ, напряжение линзы 6 кВ, диапазон масс от 2000 до 20000 м/ я ).Три независимых масс-спектра с 240 выстрелами (из разных положений целевого пятна) для каждого спектра были получены из каждого пятна, чтобы получить 24 реплики спектров, откалиброванных снаружи с использованием стандарта для бактериальных испытаний (Bruker Daltonics GmbH, Бремен, Германия). Впоследствии наборы спектральных данных были импортированы в программное обеспечение ClinPro Tools (версия 3.0, Bruker Daltonics, GmbH, Бремен, Германия) для интеллектуального анализа данных после выделения пиков на рассчитанном общем среднем спектре с установкой порога отношения сигнал-шум (S/N) на уровне 3, вычитание базовой линии (Top Hat) и расчет пиковой интенсивности.
4, Bruker Daltonics). GmbH, Бремен, Германия), работающий в положительном линейном режиме (частота лазера 20 Гц, напряжение ионного источника 1 20 кВ, ионного источника 2 напряжение 18,4 кВ, напряжение линзы 6 кВ, диапазон масс от 2000 до 20000 м/ я ).Три независимых масс-спектра с 240 выстрелами (из разных положений целевого пятна) для каждого спектра были получены из каждого пятна, чтобы получить 24 реплики спектров, откалиброванных снаружи с использованием стандарта для бактериальных испытаний (Bruker Daltonics GmbH, Бремен, Германия). Впоследствии наборы спектральных данных были импортированы в программное обеспечение ClinPro Tools (версия 3.0, Bruker Daltonics, GmbH, Бремен, Германия) для интеллектуального анализа данных после выделения пиков на рассчитанном общем среднем спектре с установкой порога отношения сигнал-шум (S/N) на уровне 3, вычитание базовой линии (Top Hat) и расчет пиковой интенсивности.
2.3. Расщепление белков в растворе
Белковые экстракты (образцы A и B LC ) подвергали восстановлению, алкилированию и расщеплению трипсином в соответствии с протоколом подготовки образцов с фильтрацией (FASP) [11].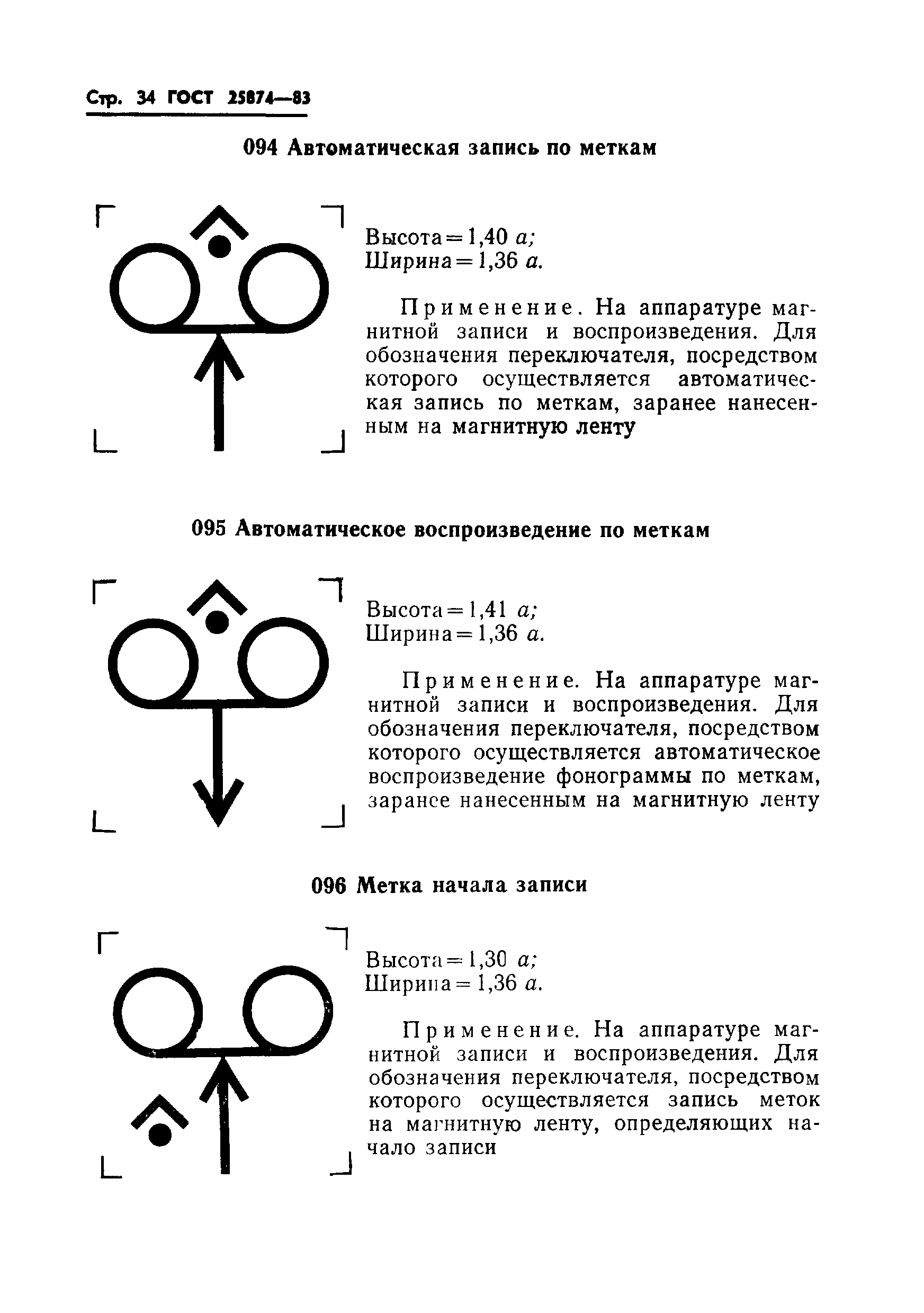 Вкратце, белковые экстракты загружали в центробежный фильтр Microcon-10kDa с мембраной Ultracel-10 (Merck, Burlington, MA, USA) в присутствии 8 М мочевины и 100 мМ трис-HCl, pH 8,5; дисульфидные связи восстанавливали в течение 15 минут при 37 °C с помощью 8 мМ DTT, затем образцы инкубировали с 50 мМ йодацетамидом в течение 15 минут, а затем с DTT и расщепляли 1 мкг трипсина для секвенирования (Promega, Милан, Италия) при 37 °C в 50 мМ буфере бикарбоната аммония, pH 8.0, ночь (16 ч). Пептиды элюировали из Microcon, сушили спидвакуумом и ресуспендировали в водном растворе с 2% ACN и 0,1% FA. Общее содержание пептидов определяли с помощью анализа NanoDrop 2000 (Thermo Fisher Scientific, Waltham, MA, USA) со стандартной кривой расщепления MassPrep Escherichia coli (Waters, Milford, MA, USA).
Вкратце, белковые экстракты загружали в центробежный фильтр Microcon-10kDa с мембраной Ultracel-10 (Merck, Burlington, MA, USA) в присутствии 8 М мочевины и 100 мМ трис-HCl, pH 8,5; дисульфидные связи восстанавливали в течение 15 минут при 37 °C с помощью 8 мМ DTT, затем образцы инкубировали с 50 мМ йодацетамидом в течение 15 минут, а затем с DTT и расщепляли 1 мкг трипсина для секвенирования (Promega, Милан, Италия) при 37 °C в 50 мМ буфере бикарбоната аммония, pH 8.0, ночь (16 ч). Пептиды элюировали из Microcon, сушили спидвакуумом и ресуспендировали в водном растворе с 2% ACN и 0,1% FA. Общее содержание пептидов определяли с помощью анализа NanoDrop 2000 (Thermo Fisher Scientific, Waltham, MA, USA) со стандартной кривой расщепления MassPrep Escherichia coli (Waters, Milford, MA, USA).
2.4. Жидкостная хроматография – ионизация электрораспылением – тандемная МС (ЖХ-ESI-MS/MS)
Эксперименты LC-ESI-MS/MS проводились на системе UltiMate3000 RSLCnano, непосредственно соединенной с масс-спектрометром Orbitrap Fusion Tribrid, работающим в режиме положительной ионизации, оснащен источником nanoESI (EASY-Spray NG) (Thermo Fisher Scientific, Waltham, MA, USA).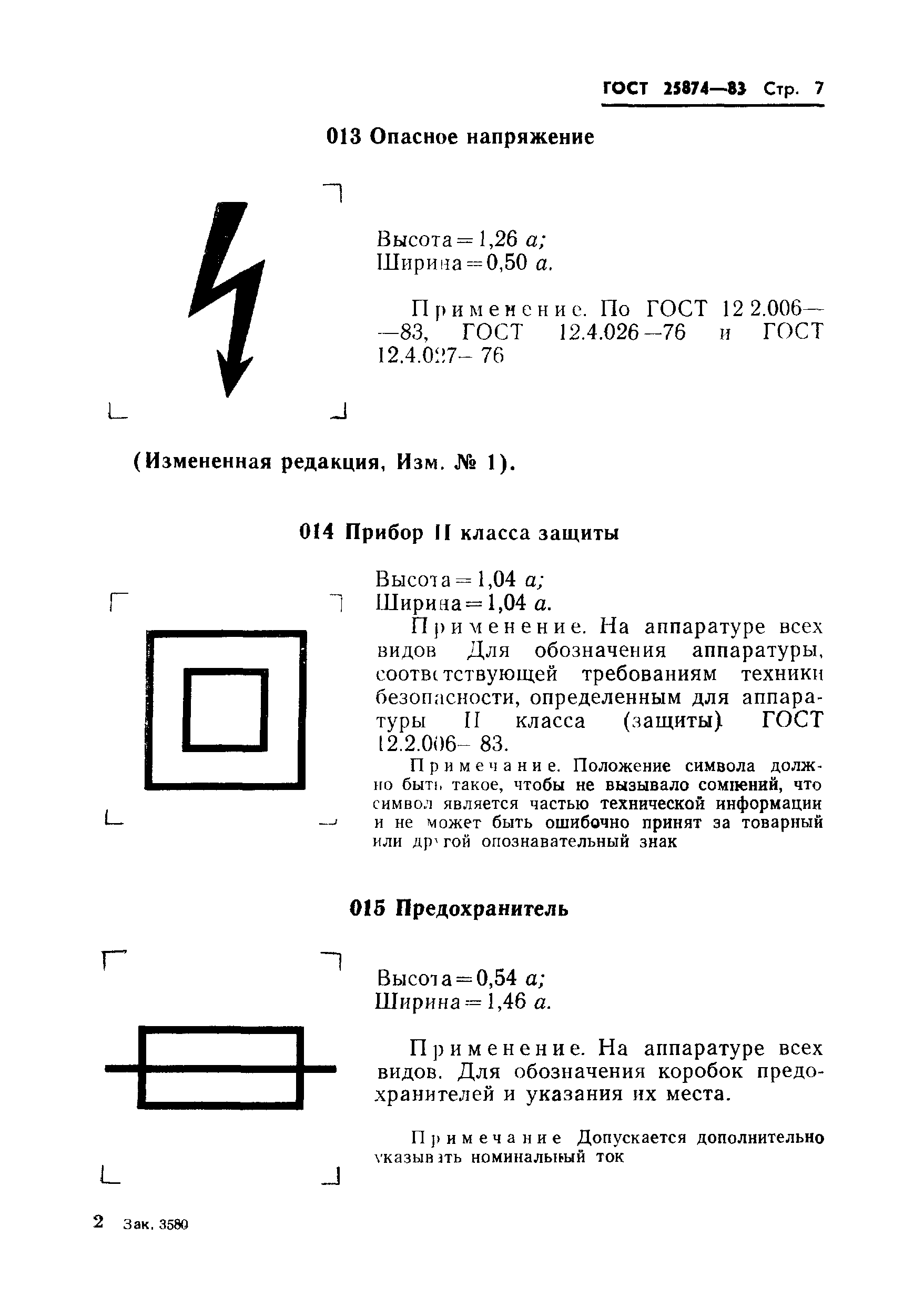 Расщепленные белки (1,25 мкг) сначала улавливали и обессоливали на картридже с микропредколонками C18 PepMap100 (размер частиц 5 мкм, размер пор 100 Å, внутренний диаметр 300 мкм × длина 5 мм, Thermo Fisher Scientific, Уолтем, Массачусетс, США) для 3 мин при 10 мкл/мин, с водным раствором 2% ACN и 0,1% TFA, а затем разделение с помощью обращенно-фазовой хроматографии, выполненной на колонке EASY-Spray PepMap RSLC C18 (размер частиц 2 мкм, размер пор 100 Å, внутр. диаметр 75 мкм × длина 50 см, Thermo Fisher Scientific, Уолтем, Массачусетс, США) при скорости потока 250 нл/мин и температуре 35 °C с одноступенчатым линейным градиентом от 95% элюента A (0.1% FA в воде) до 25% элюента B (99,9% ACN, 0,1% FA) за 113 мин и общий цикл ЖХ 160 мин. Обзорные сканы Precursor (MS1) были записаны в Orbitrap с разрешающей способностью 120 K (при m/z 200). Зависимый от данных анализ МС/МС (МС2) выполняли в режиме максимальной скорости с временем цикла 3 с, во время которого были обнаружены наиболее распространенные многозарядные (2+–7+) ионы-предшественники в диапазоне 375–1500 м/с.
Расщепленные белки (1,25 мкг) сначала улавливали и обессоливали на картридже с микропредколонками C18 PepMap100 (размер частиц 5 мкм, размер пор 100 Å, внутренний диаметр 300 мкм × длина 5 мм, Thermo Fisher Scientific, Уолтем, Массачусетс, США) для 3 мин при 10 мкл/мин, с водным раствором 2% ACN и 0,1% TFA, а затем разделение с помощью обращенно-фазовой хроматографии, выполненной на колонке EASY-Spray PepMap RSLC C18 (размер частиц 2 мкм, размер пор 100 Å, внутр. диаметр 75 мкм × длина 50 см, Thermo Fisher Scientific, Уолтем, Массачусетс, США) при скорости потока 250 нл/мин и температуре 35 °C с одноступенчатым линейным градиентом от 95% элюента A (0.1% FA в воде) до 25% элюента B (99,9% ACN, 0,1% FA) за 113 мин и общий цикл ЖХ 160 мин. Обзорные сканы Precursor (MS1) были записаны в Orbitrap с разрешающей способностью 120 K (при m/z 200). Зависимый от данных анализ МС/МС (МС2) выполняли в режиме максимальной скорости с временем цикла 3 с, во время которого были обнаружены наиболее распространенные многозарядные (2+–7+) ионы-предшественники в диапазоне 375–1500 м/с. z были выбраны для активации в порядке распространенности и обнаружены в ионной ловушке при высокой скорости сканирования.Использовалась квадрупольная изоляция с окном изоляции 1,6 m/z , а динамическое исключение включалось на 60 с после однократного сканирования. Целевые значения автоматической регулировки усиления составляли 4,0 × 10 5 для MS1 и 2,0 × 10 3 для MS2 с максимальным временем ввода 50 и 300 мс соответственно. Для MS2 порог интенсивности сигнала составлял 5,0 × 10 3 , и была установлена опция «Инжекция ионов за все доступное распараллеливаемое время». Высокоэнергетическую столкновительную диссоциацию (HCD) проводили с использованием 30% нормализованной энергии столкновения.Блокировочную массу устанавливали в качестве внутренней калибровки с использованием полидиметилциклосилоксана (445.12003 m/z ).
z были выбраны для активации в порядке распространенности и обнаружены в ионной ловушке при высокой скорости сканирования.Использовалась квадрупольная изоляция с окном изоляции 1,6 m/z , а динамическое исключение включалось на 60 с после однократного сканирования. Целевые значения автоматической регулировки усиления составляли 4,0 × 10 5 для MS1 и 2,0 × 10 3 для MS2 с максимальным временем ввода 50 и 300 мс соответственно. Для MS2 порог интенсивности сигнала составлял 5,0 × 10 3 , и была установлена опция «Инжекция ионов за все доступное распараллеливаемое время». Высокоэнергетическую столкновительную диссоциацию (HCD) проводили с использованием 30% нормализованной энергии столкновения.Блокировочную массу устанавливали в качестве внутренней калибровки с использованием полидиметилциклосилоксана (445.12003 m/z ).
2.5. Поиск в базе данных и идентификация белков
Идентификаторы белков были получены с помощью встроенной поисковой системы (Sequest HT) программного обеспечения Proteome Discoverer (PD, версия 2. 4, Thermo Fisher Scientific, Уолтем, Массачусетс, США) после поиска в специально созданной базе данных, содержащей полный каталог записей последовательностей UniProtKB/Swiss-Prot (561 568 белков, выпуск: 2019_11), к которому относятся Anisakis UniProtKB/TrEMBL (25 874 белка, выпуск: 2019_11) и «Лосось» UniProtKB/TrEMBL (233 298 белков, выпуск: 2020_01) последовательностей были добавлены.Параметры поиска включали трипсин в качестве протеолитического фермента с максимально допустимым количеством 2 пропущенных расщеплений на пептид и окисление метионина в качестве переменной модификации, тогда как карбамидометилирование цистеина было установлено в качестве статической модификации. Допуск по массе предшественника и фрагмента был установлен на 10 частей на миллион и 0,6 Да соответственно. Частота ложных открытий (FDR) была рассчитана с помощью алгоритма Percolator, и для идентификаций использовалось пороговое значение 0,01 (т. е. ожидаемая доля неправильных совпадений белка во всем наборе данных была установлена менее 1%, рассчитанной по базу данных приманок).
4, Thermo Fisher Scientific, Уолтем, Массачусетс, США) после поиска в специально созданной базе данных, содержащей полный каталог записей последовательностей UniProtKB/Swiss-Prot (561 568 белков, выпуск: 2019_11), к которому относятся Anisakis UniProtKB/TrEMBL (25 874 белка, выпуск: 2019_11) и «Лосось» UniProtKB/TrEMBL (233 298 белков, выпуск: 2020_01) последовательностей были добавлены.Параметры поиска включали трипсин в качестве протеолитического фермента с максимально допустимым количеством 2 пропущенных расщеплений на пептид и окисление метионина в качестве переменной модификации, тогда как карбамидометилирование цистеина было установлено в качестве статической модификации. Допуск по массе предшественника и фрагмента был установлен на 10 частей на миллион и 0,6 Да соответственно. Частота ложных открытий (FDR) была рассчитана с помощью алгоритма Percolator, и для идентификаций использовалось пороговое значение 0,01 (т. е. ожидаемая доля неправильных совпадений белка во всем наборе данных была установлена менее 1%, рассчитанной по базу данных приманок). Для идентификации белка рассматривали не менее двух пептидов.
Для идентификации белка рассматривали не менее двух пептидов.
2.6. Функциональный анализ
Картирование ортологичных генов из списков белков в Caenorhabditis elegans было выполнено с помощью инструмента g:Orth веб-сервера g:Profiler на основе данных, собранных в базе данных Ensembl [12,13] и с помощью STRING ( версия 11.0, база данных 11_0) [14,15]. Биоинформатический анализ был выполнен с помощью функции g:GOSt программного обеспечения g:Profiler, чтобы выполнить статистический анализ обогащения, чтобы найти чрезмерное представление информации из терминов Gene Ontology (GO) и биологических путей Киотской энциклопедии генов и геномов (KEGG).Наиболее значимые категории, связанные с загруженными наборами данных, были идентифицированы путем расчета связанной значимости (значение p ) при сравнении списка белков со всем протеомом C. elegans . Значение p измеряет вероятность того, что ассоциация между генами/белками в наборах данных и каждым термином GO и KEGG не является результатом одного только случайного случая, определяя значительное чрезмерное представительство молекул в связи с данным процессом. Мы применили пороговое значение p для всего эксперимента, равное 0,05, ограничив FDR (т. е. ожидаемую долю ложных срабатываний среди значимых терминов) менее чем 5%; g:GOSt использует множественную коррекцию тестирования и применяет специальный алгоритм g:SCS для снижения показателей значимости.
Мы применили пороговое значение p для всего эксперимента, равное 0,05, ограничив FDR (т. е. ожидаемую долю ложных срабатываний среди значимых терминов) менее чем 5%; g:GOSt использует множественную коррекцию тестирования и применяет специальный алгоритм g:SCS для снижения показателей значимости.
Анализ сетей белок-белкового взаимодействия проводили с помощью приложения STRING. Наивысшая достоверность 0,9 была выбрана в качестве минимально необходимого порога оценки взаимодействия, так что только взаимодействия выше этой оценки были включены в прогнозируемые сети.Сети были кластеризованы с помощью алгоритма марковской кластеризации (MCL) с параметром инфляции, установленным равным 3 (косвенно связанным с точностью кластеризации, т. Е. Чем выше инфляция, тем больше кластеров).
3. Результаты
3.1. Экспериментальный трубопровод
После механической гомогенизации и обработки ультразвуком образцы, полученные от пяти личинок, обрабатывали в соответствии с протоколом MALDI Sepsityper Kit (Bruker Daltonics, GmbH, Бремен, Германия). Чтобы использовать преимущества различных протеомных стратегий, в текущем исследовании был предпринят комбинированный подход, основанный на двух платформах масс-спектрометрии ().
Чтобы использовать преимущества различных протеомных стратегий, в текущем исследовании был предпринят комбинированный подход, основанный на двух платформах масс-спектрометрии ().
3.2. Профилирование белка с помощью анализа MALDI-TOF MS
После экстракции белка, нанесения пятен и анализа МС были выделены высокоинтенсивные пики в диапазоне 2000–12 000 Да ( m/z ) у пяти личинок (образец B M ), с наибольшей плотностью в области между 2500 и 8000 Да, с кластерами сигналов в диапазонах, соответствующих 2700–2900, 5400–5700 и 7100–7500 Да (; ).
Репрезентативное профилирование белков Anisakis spp.биотипером MALDI–TOF MS. Изображен средний спектр для каждого образца, а также средний спектр, полученный из всего набора данных спектров. Значения m/z выражены в дальтонах, а интенсивности сигналов представлены в шкале произвольных единиц (усл. ед.).
Псевдогельный вид пяти личинок (образцы B M ) из профилирования MALDI–TOF MS. Значения массы к заряду ( m/z , Da) представлены по оси x, в то время как полоса шкалы серого, представленная по правой оси y, показывает взаимосвязь между интенсивностью цвета и пиковой интенсивностью. выражается в условных единицах (усл.у.). На левой оси y показаны номера спектров (Sp.#).
Значения массы к заряду ( m/z , Da) представлены по оси x, в то время как полоса шкалы серого, представленная по правой оси y, показывает взаимосвязь между интенсивностью цвета и пиковой интенсивностью. выражается в условных единицах (усл.у.). На левой оси y показаны номера спектров (Sp.#).
Подчеркнута фенотипическая изменчивость личинок, проверенная кластерным анализом, проведенным на полном наборе данных: масс-спектры личинок 1 и 4 сгруппированы вместе и образовали одну кладу с личинкой 5; личинки 2 и 3 были более похожи и идентифицировали другой кластер ().
Дендрограмма спектра (путем неконтролируемой иерархической кластеризации), полученная путем анализа всех спектральных реплик MALDI-TOF MS от личинок Anisakis .
Набор данных масс-спектров каждой личинки был сгруппирован в разные классы, а отсечка ≤8 по разнице между максимальной и минимальной средней пиковой интенсивностью всех классов (DAve), минимальная средняя пиковая интенсивность 2,5 ( Ave) и 20% коэффициента вариации (CV) для каждого класса. Независимо от изменчивости, выявленной с помощью дендрограммного анализа, было дополнительно идентифицировано 19 сигналов (из общего числа 179) для всех образцов, представляющих набор классификаторов фингерпринтинга Anisakis spp.().
Независимо от изменчивости, выявленной с помощью дендрограммного анализа, было дополнительно идентифицировано 19 сигналов (из общего числа 179) для всех образцов, представляющих набор классификаторов фингерпринтинга Anisakis spp.().
Таблица 1
Избранные эталонные сигналы для идентификации Anisakis spp. DAve, разница между максимальной и минимальной средней интенсивностью пика, Ave, средняя интенсивность пика, CV, коэффициент вариации.
9 9| # Пик | м/з | Dave | Ave | CV (%) | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 3 | 4 | 5 | 1 | 2 | 3 | 4 | 5 | ||||||||||
| 1 | 2597. 26 26 | 0,97 | 2,63 | 2,57 | 2,55 | 3,52 | 3,12 | 19,32 | 16,09 | 15,34 | 15,86 | 18,74 | |||||
| 2 | 2654,85 | 3,6 | 4,41 | 7. 84 84 | 70230 | 7.78 | 4,24 | 5.08 | 17.08 | 17.66 | 15.12 | 12.49 | 12.49 | 10.57 | 14.7 | ||
| 3 | 2704.25 | 1,26 | 2,91 | 3. 7 7 | 3,51 | 4,15 | 2,89 | 10,86 | 11,12 | 15,85 | 16,27 | 14,07 | |||||
| 4 | 2724,12 | 3,66 | 4.6 | 7.84 | 70230 | 4,4 | 4.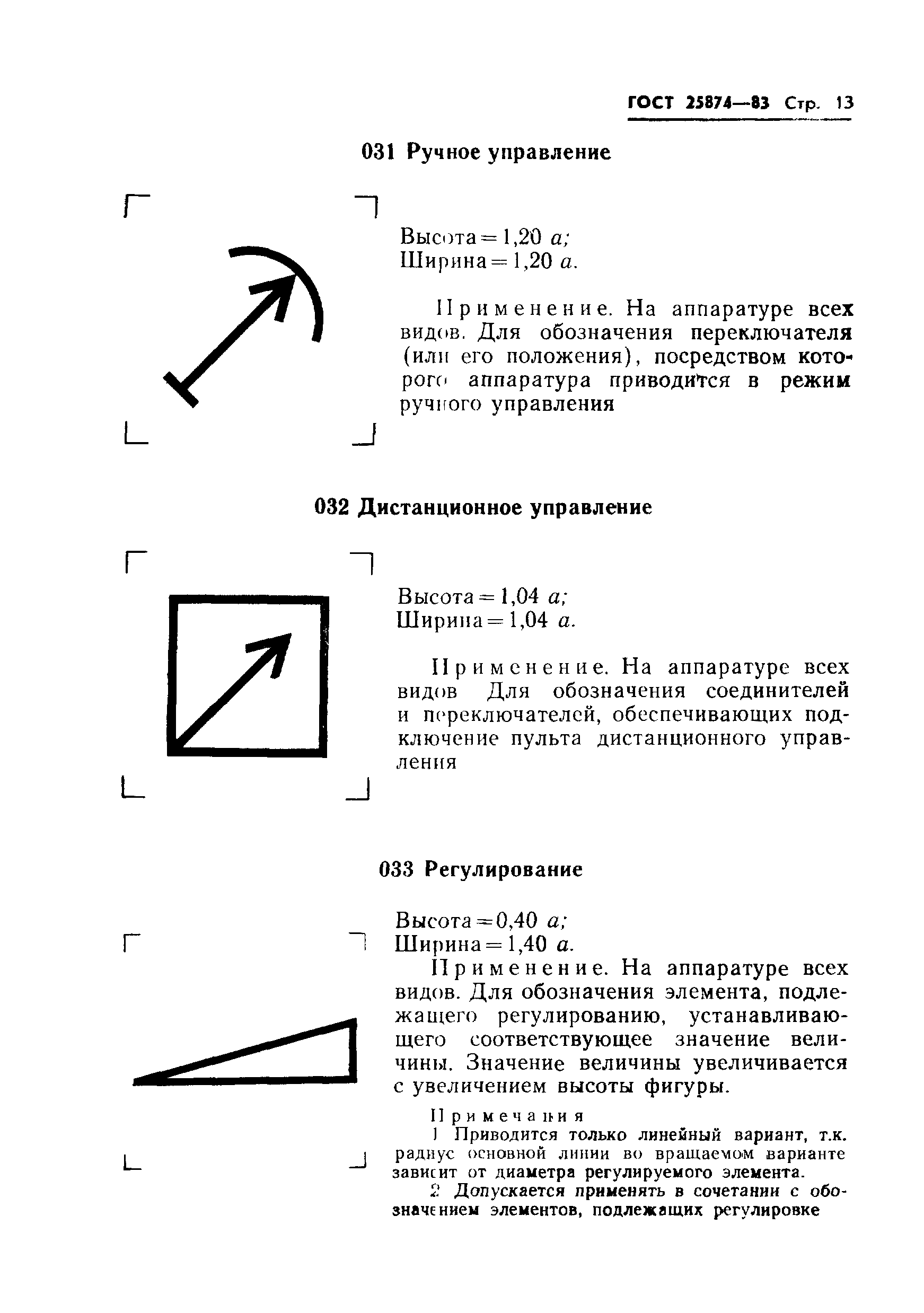 18 18 | 4,47 | 18.86 | 18.86 | 12.1 | 12.99 | 13.48 | 13.98 | 17.98 | ||
| 5 | 2733.01 | 0,98 | 3,52 | 4,5 | 4,26 | 3,68 | 3,56 | 16,22 | 14,21 | 9,88 | 17,98 | 13,54 | |||||
| 6 | 2741,79 | 1,25 | 3,63 | 4. 47 47 | 4.47 | 4.47 | 3.94 | 3.22 | 15.67 | 15.67 | 13.38 | 13.38 | 13.73 | 15.86 | 15.86 | ||
| 7 | 2758.46 | 1,13 | 4,21 | 3,22 | 3,98 | 4,35 | 3,35 | 14,8 | 12,06 | 8,77 | 11,37 | 18,26 | |||||
| 8 | 2781,06 | 1,35 | 4,0 | 4.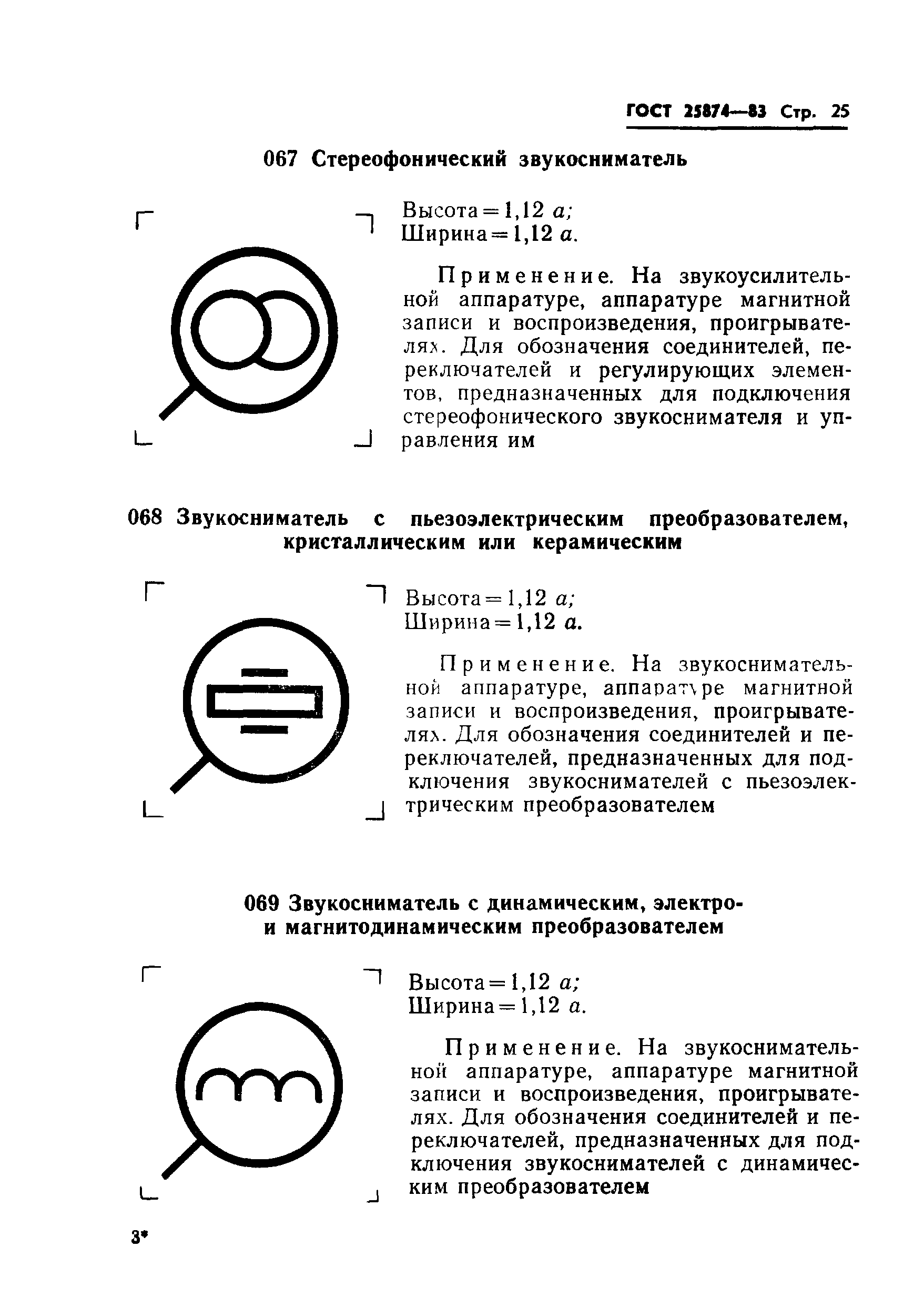 5 5 | 5.11 | 5.11 | 4.0 | 3.76 | 9.79 | 9.77 | 11.77 | 9.01 | 11.98 | 19.07 | |||
| 9 | 2807.87 | 0.82 | 3,39 | 3,71 | 3,61 | 3,75 | 2,92 | 16,69 | 12,95 | 11,4 | 17,88 | 16,87 | |||||
| 10 | 2827,16 | 0,6 | 3,25 | 3,72 | 3.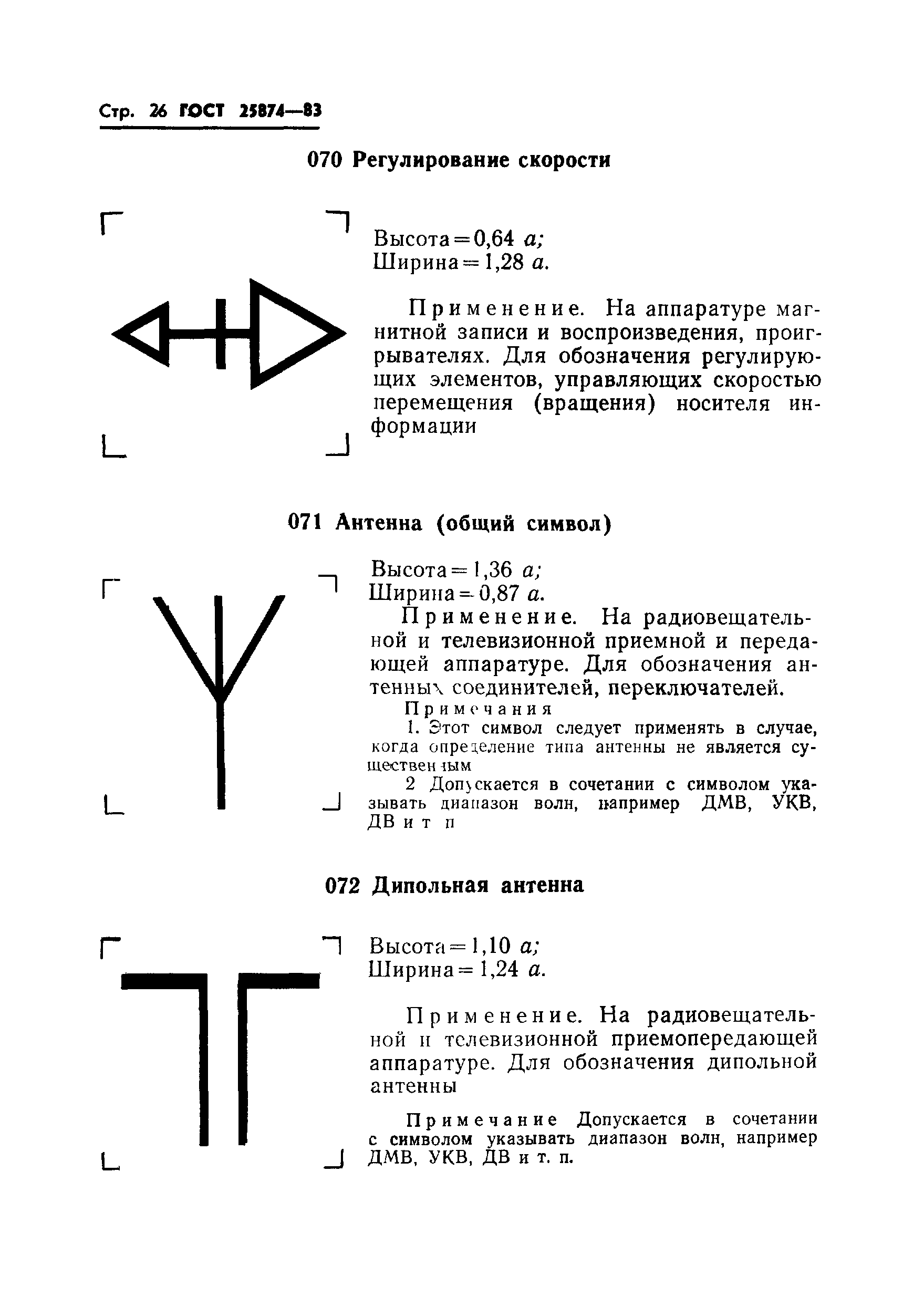 55 55 | 3.29 | 3.29 | 3.12 | 14.97 | 14.97 | 14.48 | 14.48 | 14.82 | 17.82 | 19.86 | ||
| 11 | 2834.32 | 0.71 | 3,85 | 4,56 | 3,99 | 4,15 | 4,13 | 10,02 | 14,2 | 14,82 | 12,6 | 16,51 | |||||
| 12 | 2840,23 | 1,8 | 3,91 | 2,82 | 3. 98 98 | 4.54 | 4.54 | 4,63 | 14.68 | 14.68 | 7.22 | 11.06 | 11.06 | 10.73 | 19.48 | 19.48 | |
| 13 | 4969.15 | 1.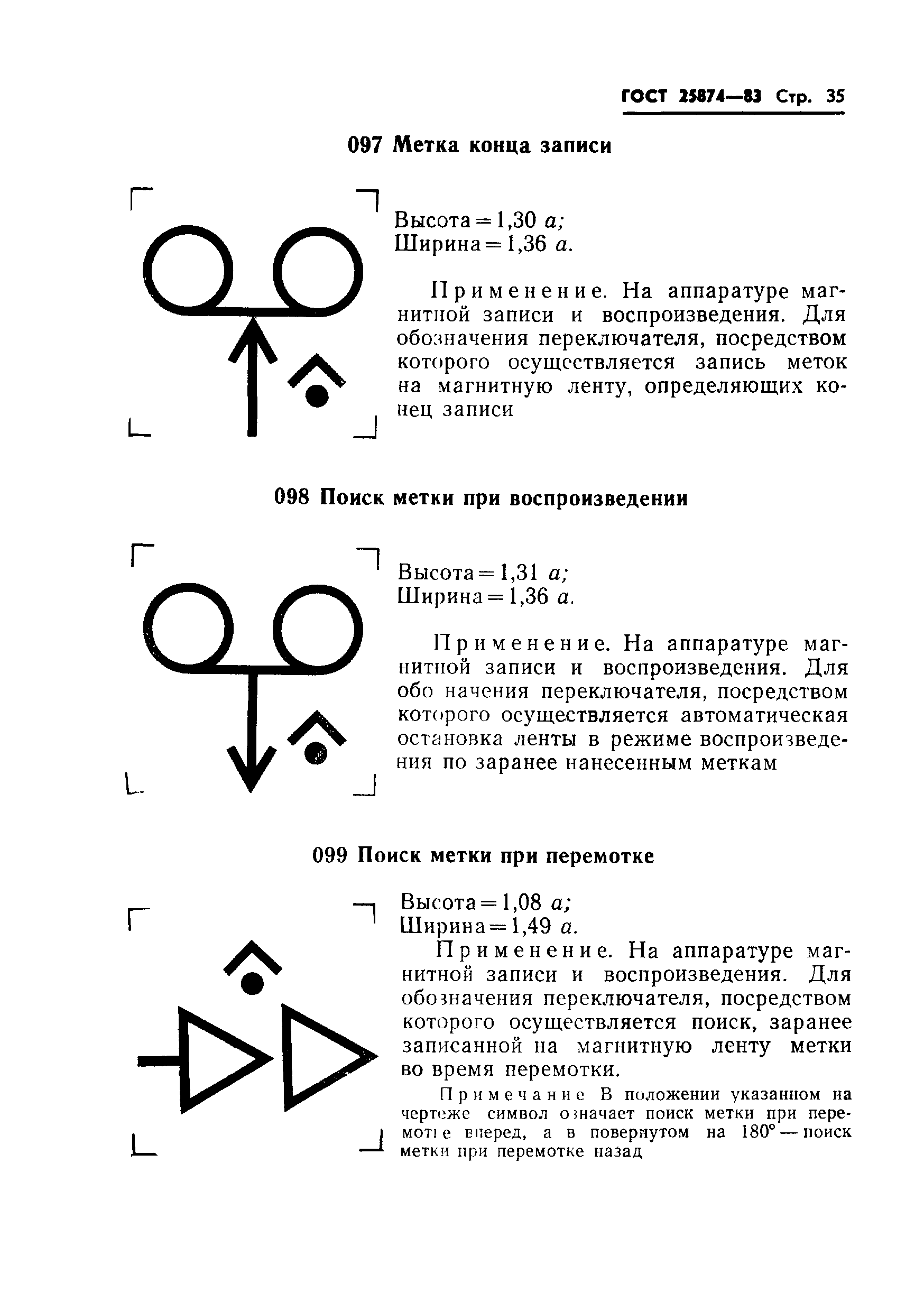 4 4 | 4,23 | 4,33 | 4,24 | 3,73 | 2,92 | 12,47 | 14,59 | 12,16 | 10,67 | 12,37 | |||||
| 14 | 5335,65 | 3,25 | 2,98 | 4,36 | 5. 38 38 | 2.81 | 6.05 | 6.05 | 14.79 | 12.79 | 12.28 | 12 | 11.62 | 15.62 | 15.81 | ||
| 15 | 5370.57 | 1.75 | 2,73 | 3,57 | 4,47 | 3,14 | 3,91 | 16,47 | 16,83 | 16,68 | 14,81 | 12 | |||||
| 16 | 5656,33 | 7,86 | 8,48 | 13,73 | 12. 95 95 | 5.87 | 5.97 | 10.19 | 11.46 | 11.46 | 9.92 | 14.32 | 14.32 | 19.42 | 19.42 | ||
| 17 | 5694.2 | 1.87 | 5,67 | 5,31 | 5,46 | 7,19 | 7,08 | 7,24 | 7. 8 8 | 10,33 | 18,31 | 12,79 | |||||
| 18 | 5712,76 | 6,26 | 5,97 | 11,04 | 9.91 | 4.78 | 5.74 | 5.74 | 9.99 | 9. 07 07 | 9.14 | 13.13 | 13.13 | 13.56 | |||
| 19 | 7166.45 | 5.19 | 7 | 7 | 798 | 2.99 | 3.43 | 2.98 | 5. 14 14 | 5.14 | 14.63 | 14,63 | 14.19 | 14.1 | 14.43 | 15.45 | 15.45 |
3.3. Профилирование белка с помощью тандемной масс-спектрометрии
После ферментативного расщепления и очистки пептидов мы определили общее содержание белка на двух этапах экстракции принятого протокола с помощью ЖХ-ЭСИ-МС/МС на платформе высокого разрешения. Из образца А личинок 1, 2, 3, 4 и 5 мы идентифицировали общее количество 2179 различных белков, из которых 561 был идентифицирован как общий; в образце B LC мы идентифицировали в общей сложности 3091 разнообразный белок, из которых 210 были общими для пяти личинок (дополнительный материал S1).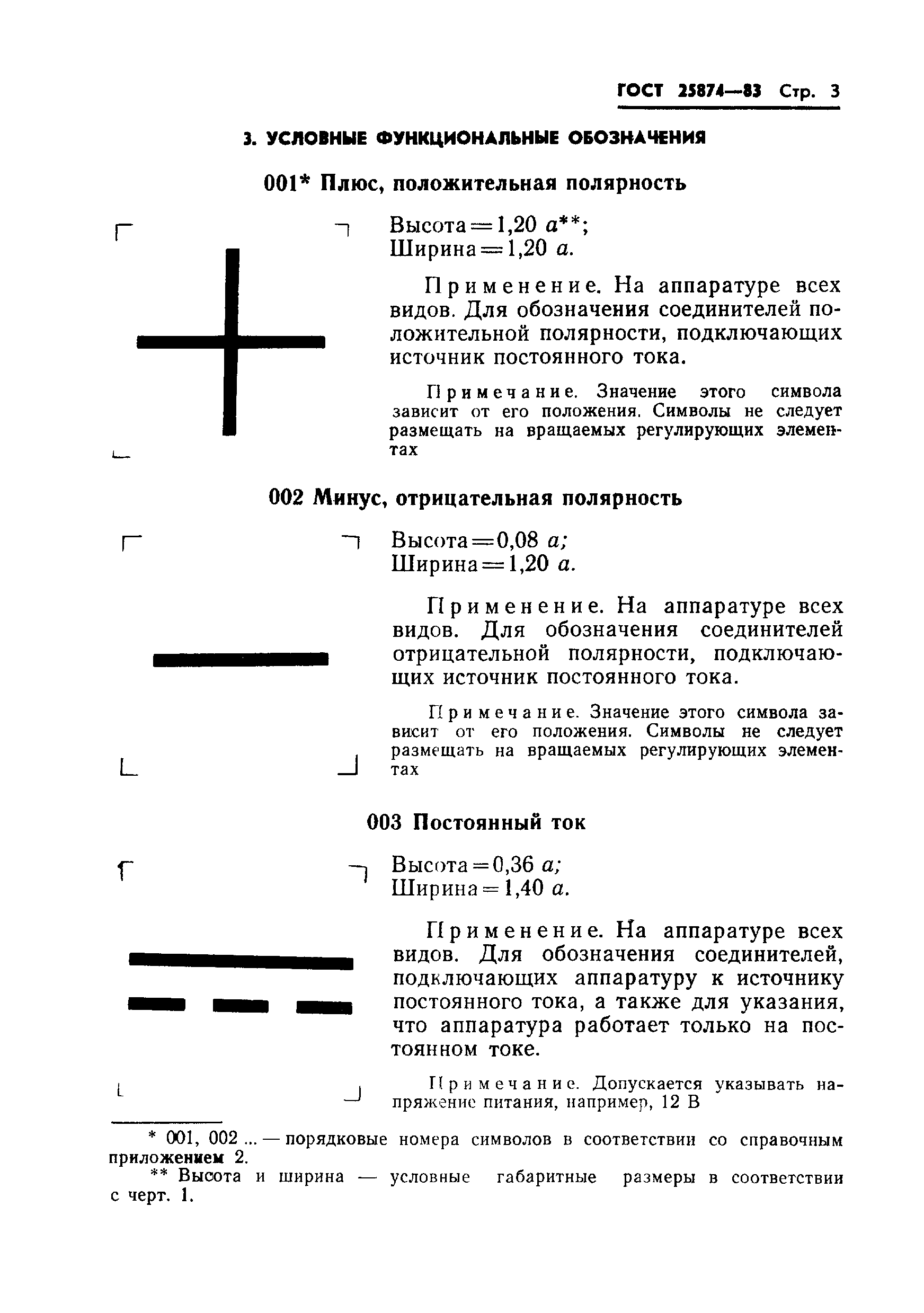 Мы сосредоточили наш функциональный анализ только на идентифицированных белках, принадлежащих видам Anisakis и организмам, отобранным в соответствии с филогенетическим сходством (порядок Rhabditida [16], 1732 и 1543 суммарных различных белка в образце A и B соответственно) (, Дополнительный материал S2) .
Мы сосредоточили наш функциональный анализ только на идентифицированных белках, принадлежащих видам Anisakis и организмам, отобранным в соответствии с филогенетическим сходством (порядок Rhabditida [16], 1732 и 1543 суммарных различных белка в образце A и B соответственно) (, Дополнительный материал S2) .
Обзор белков, идентифицированных с помощью анализа LC-ESI-MS/MS. Диаграммы Венна показывают количество белков Rhabditida и их распределение в пяти проанализированных личинках, выделяя общие и исключительные белки (номера в окрашенных областях) в образцах A ( a ) и B LC ( b ).Распределение организмов (в процентах от идентифицированных белков) на уровне таксономии отряда Rhabditida в образцах A и B показано гистограммами ( c ).
Списки идентифицированных белков, принадлежащих к отряду Rhabditida, были отфильтрованы с помощью трехэтапного процесса ():
учитывались только белки, идентифицированные как минимум у четырех из пяти личинок (дополнительный материал S3);
белки с разными кодами доступа UniProtKB, но с одним и тем же названием были свернуты в одно попадание;
белка, определенных как неизвестные, были удалены (дополнительный материал S4).

Фильтры, применяемые к спискам белков перед выполнением функционального биоинформатического анализа. KEGG, Киотская энциклопедия генов и геномов.
Функциональный анализ
Отфильтрованные списки белков были проверены на наличие известных терминов GO, извлечены с помощью приложения ProteinCenter программного обеспечения PD и сгруппированы по соответствующим категориям в процентах по отношению к общим терминам каждого образца. Наиболее представленный биологический процесс, клеточный компонент и молекулярная функция, как и ожидалось, были сходными между образцами A и B LC и были связаны с метаболическим процессом, мембраной и каталитической активностью ().
Круговая диаграмма терминов распределения Gene Ontology (GO), связанных с идентифицированными белками.
Чтобы подчеркнуть чрезмерное представление информации из терминов GO и биологических путей, а также сетей межбелковых взаимодействий, связанных с нашим набором данных, мы преобразовали два списка белков в ортологичные гены C.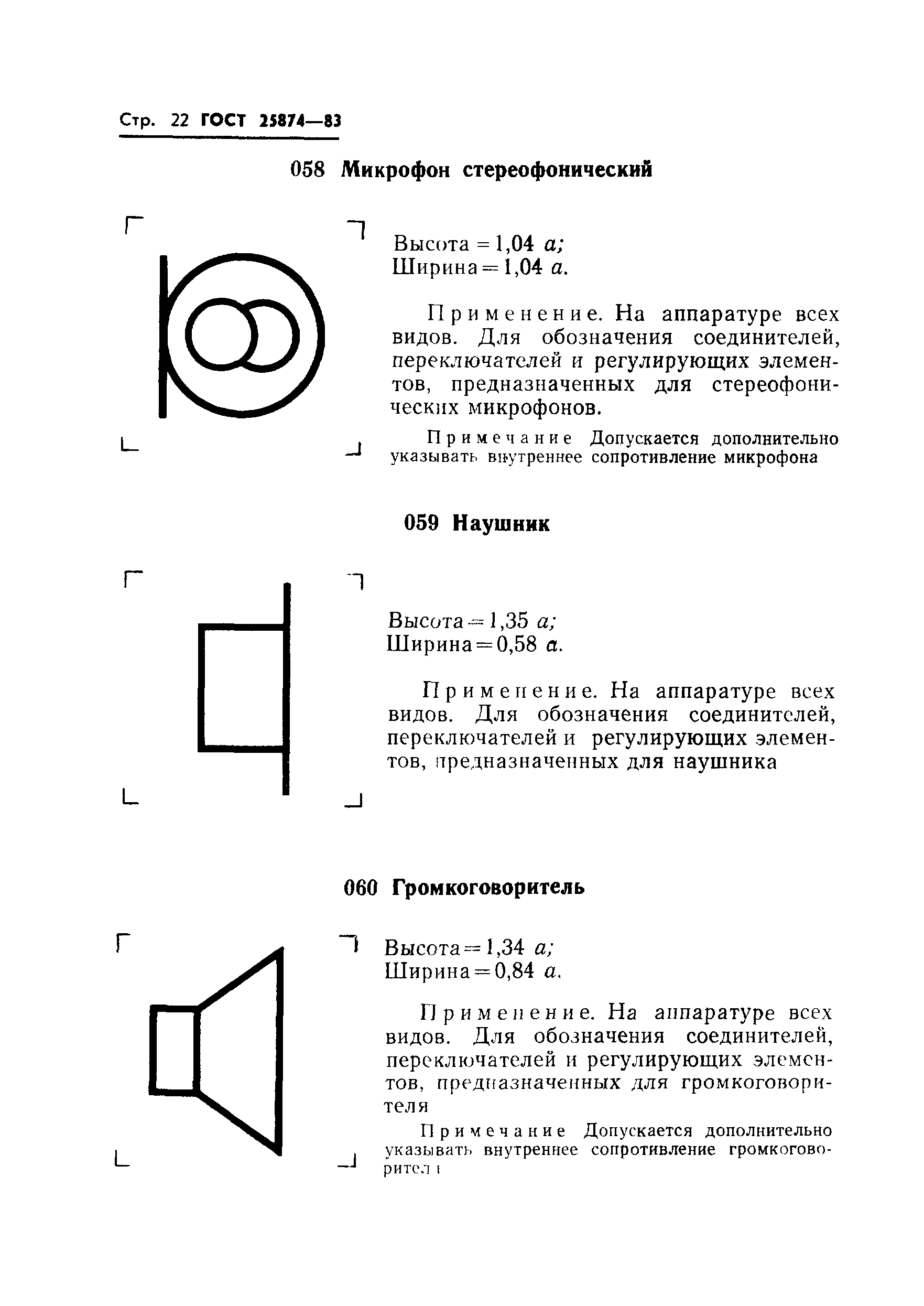 elegans ( и Дополнительный материал S5), поскольку этот модельный организм является наиболее изученным для биомедицинских исследований и доступен в веб-приложениях для анализа обогащения, в отличие от Anisakis spp.Ортологичные гены, вероятно, сохранились в результате эволюции от общего предка, могут выполнять сходные функции и, следовательно, важны для функционального анализа.
elegans ( и Дополнительный материал S5), поскольку этот модельный организм является наиболее изученным для биомедицинских исследований и доступен в веб-приложениях для анализа обогащения, в отличие от Anisakis spp.Ортологичные гены, вероятно, сохранились в результате эволюции от общего предка, могут выполнять сходные функции и, следовательно, важны для функционального анализа.
Наш конвейер по экстракции белков с последующим тандемным масс-спектрометрическим анализом привел нас к значительному обогащению белков из рибосом и связанных с путем углеродного метаболизма ( и ), а также многих других терминов ГО и биологических путей, таких как гликолиз/глюконеогенез, глиоксилат и метаболизм дикарбоксилатов, метаболические пути (дополнительный материал S6).
Манхэттенский график обогащения терминов GO и биологических путей (KEGG), результаты множественного запроса с двумя входными списками генов (A и B LC , полученный из белка). На оси x представлены функциональные термины, которые сгруппированы и имеют цветовую кодировку по источникам данных (например, молекулярная функция, MF, биологический процесс, BP, клеточный компонент, CC из GO и пути KEGG, красные, зеленые, оранжевые и фиолетовые). , соответственно). По оси Y показаны скорректированные значения обогащения p в отрицательной логарифмической шкале 10 ).Выделены и пронумерованы круги термов со значениями p менее 1,0 × 10 −16 (высокая значимость) хотя бы в одной выборке. Размеры кругов соответствуют размерам соответствующих терминов (т. е. более крупные термины, что означает большее количество совпадений конкретного термина, извлеченного из набора данных, соответствуют большим кругам).
, соответственно). По оси Y показаны скорректированные значения обогащения p в отрицательной логарифмической шкале 10 ).Выделены и пронумерованы круги термов со значениями p менее 1,0 × 10 −16 (высокая значимость) хотя бы в одной выборке. Размеры кругов соответствуют размерам соответствующих терминов (т. е. более крупные термины, что означает большее количество совпадений конкретного термина, извлеченного из набора данных, соответствуют большим кругам).
Таблица 2
Термины GO и анализ обогащения биологических путей (KEGG).
-26 9029 -16 9029 9 -20 —19| Срок | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Группа | Количество круга () | Термин Имя | Term ID P -Value P -Value 2 | |||||||
| Образец 2 | Образец B LC | |||||||||
| MF | 1 | структурный компонент рибосомы | GO:0003735 | 4. 07 × 10 -26 07 × 10 -26 | 1.10 × 10 -04 | 9029 2 | Структурная молекула: 0005198 | Go: 0005198 | 1.42 × 10 -18 | 6.53 × 10 -07 |
| BP | 3 | Перевод | Go: 0006412 | 5.30 × 10 -21 | 1. 10 × 10 -04 10 × 10 -04 | |||||
| 4 | Пептид Биосинтетический процесс | Go: 0043043 | 1.11 × 10 -20 | 1.38 × 10 -04 | ||||||
| 5 | амид биосинтетический процесс | GO: 0043604 | 2,53 × 10 -20 | 2,32 × 10 -05 | ||||||
| 9 | ||||||||||
| 20 | Генерация метаболитов предшественника и энергии | Go: 0006091 | 1. 23 × 10 -16 23 × 10 -16 | 6.24 × 10 -18 | ||||||
| CC | 6 | CytoPlasm | GO: 0005737 | 2.19 × 10 -82 | 6.58 × 10 -40 | |||||
| 7 | Интраклеточный | Go: 0005622 | 7.43 × 10 -55 | 1,82 × 10 -22 | ||||||
| 8 | 8 | Cytosolic Ribosome | Go: 0022626 | 7. 86 × 10 -38 86 × 10 -38 | 4.04 × 10 -10 | |||||
| 9 | Cytosol | Go: 0005829 | 3.35 × 10 -36 | 1.37 × 10 -21 | ||||||
| 10 | Рибосома | Go: 0005840 | 4.02 × 10 -29 | 8.32 × 10 -06 | ||||||
| 11 | RiboSomal Subunit | Go : 0044391 | 1,05 × 10 -27 | 5. 91 × 10 -07 91 × 10 -07 | ||||||
| 12 | Go: 0043229 | 70229 | 7.65 × 10 -23 | 1.76 × 10 — 05 | ||||||
| 13 | органелла | GO:0043226 | 1.01 × 10 -21 | 80 × 10 -05 | ||||||
| Cytosolic Большой рибосомальный субъединица | Go: 0022625 | 1. 98 × 10 -20 98 × 10 -20 | 9.33 × 10 -05 | |||||||
| 15 | 15 | Протеинсодержащий комплекс | Go: 0032991 | 6.21 × 10 -20 | 5.83 × 10 -08 | |||||
| 16 | Mitochondrion | Go: 0005739 | 3 .42 × 10 -19 | 6. 19 × 10 -13 19 × 10 -13 | ||||||
| 17 | 17 | Go: 19 | 6.95 × 10 -18 | 5.88 × 10 -03 | ||||||
| 18 | 18 | Cytosolic Маленький рибосомальный субъединица | Go: 0022627 | 4,34 × 10 -17 | 1,23 × 10 -04 | |||||
| Kegg | 19 | Углеродный метаболизм | Kegg: 01200 | 9. 55 × 10 −20 55 × 10 −20 | 1,69 × 10 −27 |
Следовательно, сетевой анализ показал наличие основного кластера рибосомных белков в образце A () и образце B LC ( () На самом деле, группа белков, хотя бы частично биологически связанных, обеспечивает больше взаимодействий, чем случайный набор белков аналогичного размера, взятых из генома; это указывало на обогащение структурных компонентов, связанных с рибосомами, и на трансляцию.
Сетевой анализ образца А.Узлы сети представляют собой белки, а ребра представляют собой предсказанные функциональные ассоциации. Выделенный красный кластер относится к рибосомным белкам.
Сетевой анализ образца B LC . Выделенный синий кластер относится к рибосомным белкам.
4. Обсуждение
Клинические лаборатории используют технологию MALDI-TOF MS для идентификации патогенных микроорганизмов, включая бактерии, дрожжевые и мицелиальные грибы, благодаря простоте использования, скорости анализа, экономической эффективности и точности идентификаторы. Анализ MALDI-TOF MS позволяет обнаруживать различные типы биомолекул в диапазоне концентраций, близких к субфемтомолям; в клинической диагностике пептиды и белки являются классификаторами фингерпринтов [17]. В частности, одно из основных преимуществ именно этого подхода — быстрота — основывается на наличии наборов масс-спектров, однозначно идентифицирующих организм путем сопоставления этих спектральных библиотек с сигналами, полученными от образцов.
Анализ MALDI-TOF MS позволяет обнаруживать различные типы биомолекул в диапазоне концентраций, близких к субфемтомолям; в клинической диагностике пептиды и белки являются классификаторами фингерпринтов [17]. В частности, одно из основных преимуществ именно этого подхода — быстрота — основывается на наличии наборов масс-спектров, однозначно идентифицирующих организм путем сопоставления этих спектральных библиотек с сигналами, полученными от образцов.
Кроме того, приложения соответствуют Европейской директиве по устройствам для диагностики in vitro (98/79/EC), что означает, что MALDI-TOF MS является маркировкой CE для всех устройств для диагностики in vitro (IVD), может быть легально коммерциализирован в ЕС как диагностический инструмент и связанные с ним процессы аналогичны медицинским приборам.Фактически, Bruker Biotyper и система VITEK MS получили первый статус CE-IVD в 2009 и 2011 годах соответственно, а также разрешение FDA (для обоих) в 2013 году [17]. Техника и опыт со временем росли; внедрение соответствующего программного обеспечения и справочных баз данных, а также наборов для подготовки образцов, выпускаемых поставщиком на коммерческой основе, позволило исследователям и специалистам лабораторий как увеличить количество типов микроорганизмов, которые могут быть идентифицированы, так и потенциально обрабатывать/обрабатывать «прямые образцы» (например,г. , посев крови), облегчая ведение инфицированных пациентов. Например, компания Bruker разработала набор MBT Sepsityper IVD для идентификации микроорганизмов из культур крови с использованием платформы MALDI-TOF MS [18,19,20]. Интересно, что в недавней статье сообщалось об использовании MBT Sepsityper Kit для определения профиля четырех нематод ( Dirofilaria repens , Dirofilaria immitis , Ascaris suum и Ascaris lumbricoides ) [10], что заинтриговало и побудило нас для проверки этого метода на Anisakis spp.Фактически, наша будущая цель, которая привела к представленному здесь предварительному исследованию, состоит в том, чтобы разработать конвейер для протеомного профилирования Anisakis spp. для диагностических целей; наличие набора для диагностики in vitro облегчит применение нашего метода в будущем.
, посев крови), облегчая ведение инфицированных пациентов. Например, компания Bruker разработала набор MBT Sepsityper IVD для идентификации микроорганизмов из культур крови с использованием платформы MALDI-TOF MS [18,19,20]. Интересно, что в недавней статье сообщалось об использовании MBT Sepsityper Kit для определения профиля четырех нематод ( Dirofilaria repens , Dirofilaria immitis , Ascaris suum и Ascaris lumbricoides ) [10], что заинтриговало и побудило нас для проверки этого метода на Anisakis spp.Фактически, наша будущая цель, которая привела к представленному здесь предварительному исследованию, состоит в том, чтобы разработать конвейер для протеомного профилирования Anisakis spp. для диагностических целей; наличие набора для диагностики in vitro облегчит применение нашего метода в будущем.
Хотя MALDI-TOF MS широко используется в качестве диагностического инструмента для точной идентификации бактерий, очень немногие исследования пытались перенести преимущества метода MALDI-TOF MS в клиническую паразитологию [8,9], и поэтому, насколько нам известно, не являются коммерческими базами данных спектральных библиотек MALDI-TOF MS ID.
Целью нашего исследования было оценить подтверждение концепции того, что экстракция белка на основе MBT Sepsityper Kit из личинок Anisakis и последующий сбор спектров на основе MALDI-TOF MS Biotyper может предоставить диагностические сигналы, представляющие интерес с биомедицинской точки зрения, связанные с этим Анисакис этап жизни. Предлагаемый метод будет работать для идентификации уже извлеченных личинок нематод от пациентов, чтобы улучшить текущие диагностические подходы. Хотя была установлена изменчивость пиков МС, несколько обнаруженных сигналов были статистически значимыми для представления всех образцов личинок.Это свидетельство перспективно для разработки новых диагностических инструментов для Anisakis . Мы понимаем, что определенная оценка предполагаемого здесь диагностического конвейера потребует сбора более образцов личинок Anisakis , также с разным географическим происхождением, а также контрольных образцов от разных нематод для получения точной таксономической типизации. Надеемся, что в ближайшем будущем усилия в этом направлении будут предприняты в консорциуме исследовательских и клинических лабораторий.
Надеемся, что в ближайшем будущем усилия в этом направлении будут предприняты в консорциуме исследовательских и клинических лабораторий.
Интересным результатом нашего исследования стало подтверждение того, что принятый протокол экстракции белка и анализ MALDI-TOF MS привели к получению спектров фингерпринтинга, относящихся к пептидам и белкам, принадлежащим множеству молекулярных видов рибосом, как уже известно [21]. Молекулярная масса рибосомных белков находится в пределах или около диапазона масс линейной установки MALDI-TOF MS, и наши эксперименты по профилированию дробовика с помощью тандемной MS на платформе с более высоким разрешением выявили обогащение рибосомных белков в два экспериментальных этапа. .
Более того, среди 448 белков, идентифицированных у четырех из пяти личинок (дополнительный материал S4), мы идентифицировали также белки, связанные с молекулярными механизмами инфекции, которые еще не полностью изучены [22]. Проглоченный Anisakis должен выжить в высококислотном желудке человека, проникнуть через стенку желудочно-кишечного тракта через деградацию слизистой и подслизистой оболочки и мигрировать в конечное место, вызывая повреждение тканей и воспаление. В конце концов, анизакиоз возникает как из-за повреждения тканей, так и из-за взаимодействия между иммунной системой хозяина и веществами, секретируемыми личинками или содержащимися внутри них [2].Мы идентифицировали некоторые вредные антигены (ингибитор протеиназы, соматический парамиозин, тропомиозин и белки теплового шока), в том числе Anis 2 (инвентарный номер UniProtKB: L7V1I9), Anis 4 ({«type»:»entrez-protein»,»attrs» :{«text»:»Q14QT4″,»term_id»:»122092845″,»term_text»:»Q14QT4″}}Q14QT4), Anis 5 ({«type»:»entrez-protein»,»attrs»:{ «text»:»A1IKL2″,»term_id»:»1531522173″,»term_text»:»A1IKL2″}}A1IKL2) и 8 аллергенов Anis (две изоформы: 1 и 10, A7M6S9 и {«type»:»entrez -protein»,»attrs»:{«text»:»A1IKL2″,»term_id»:»1531522173″,»term_text»:»A1IKL2″}}A1IKL2 соответственно), которые присутствуют в базе данных Allergome [23] и зарегистрирован ВОЗ/IUIS как аллергенных белков Anisakis [24].Anis 2 является цитоскелетным парамиозиновым белком, демонстрирующим высококонсервативные последовательности по отношению к парамиозинам различного происхождения (другие нематоды, насекомые, моллюски), которые объясняют перекрестную реактивность связывания IgE.
В конце концов, анизакиоз возникает как из-за повреждения тканей, так и из-за взаимодействия между иммунной системой хозяина и веществами, секретируемыми личинками или содержащимися внутри них [2].Мы идентифицировали некоторые вредные антигены (ингибитор протеиназы, соматический парамиозин, тропомиозин и белки теплового шока), в том числе Anis 2 (инвентарный номер UniProtKB: L7V1I9), Anis 4 ({«type»:»entrez-protein»,»attrs» :{«text»:»Q14QT4″,»term_id»:»122092845″,»term_text»:»Q14QT4″}}Q14QT4), Anis 5 ({«type»:»entrez-protein»,»attrs»:{ «text»:»A1IKL2″,»term_id»:»1531522173″,»term_text»:»A1IKL2″}}A1IKL2) и 8 аллергенов Anis (две изоформы: 1 и 10, A7M6S9 и {«type»:»entrez -protein»,»attrs»:{«text»:»A1IKL2″,»term_id»:»1531522173″,»term_text»:»A1IKL2″}}A1IKL2 соответственно), которые присутствуют в базе данных Allergome [23] и зарегистрирован ВОЗ/IUIS как аллергенных белков Anisakis [24].Anis 2 является цитоскелетным парамиозиновым белком, демонстрирующим высококонсервативные последовательности по отношению к парамиозинам различного происхождения (другие нематоды, насекомые, моллюски), которые объясняют перекрестную реактивность связывания IgE. Экскреторно-секреторный (ЭС) аллерген Anis 4 представляет собой эндопептидазу цистеинового типа с ингибиторной активностью, присутствующую как в экскреторных железах, так и под кутикулой. Anis 5 и Anis 8 являются другими термостабильными аллергенами ЭС и членами семейства белков нематод SXP/RAL-2. В частности, предполагается, что Anisakis 5 секретируется в желудочно-кишечном тракте человека из личинок третьей стадии Anisakis simplex ; его предполагаемая функциональная особенность переносчика ионов магния может быть выведена из его способности связывать ионы магния и структурного сходства с кальмодулином [25,26,27].Молекулы ES отвечают за множество функций во время инфекции, таких как проникновение в ткани хозяина и уклонение от иммунных ответов хозяина, и в то же время известно, что они вызывают иммунные ответы. Таким образом, предполагается, что белки ES вносят основной вклад в клинические проявления заболевания у людей [28].
Экскреторно-секреторный (ЭС) аллерген Anis 4 представляет собой эндопептидазу цистеинового типа с ингибиторной активностью, присутствующую как в экскреторных железах, так и под кутикулой. Anis 5 и Anis 8 являются другими термостабильными аллергенами ЭС и членами семейства белков нематод SXP/RAL-2. В частности, предполагается, что Anisakis 5 секретируется в желудочно-кишечном тракте человека из личинок третьей стадии Anisakis simplex ; его предполагаемая функциональная особенность переносчика ионов магния может быть выведена из его способности связывать ионы магния и структурного сходства с кальмодулином [25,26,27].Молекулы ES отвечают за множество функций во время инфекции, таких как проникновение в ткани хозяина и уклонение от иммунных ответов хозяина, и в то же время известно, что они вызывают иммунные ответы. Таким образом, предполагается, что белки ES вносят основной вклад в клинические проявления заболевания у людей [28].
Идентифицированная синтаза трегалозо-6-фосфат (A0A0M3JTQ2) может быть важна для механизма инфекции, поскольку она может быть связана с множеством физиологических и биохимических адаптивных механизмов, которые паразитические нематоды задействуют в неблагоприятных условиях окружающей среды, таких как неблагоприятный рН который Anisakis находит в желудочно-кишечном тракте человека, чтобы выжить [29].
Протеолитические ферменты, такие как пептидазы, ответственны за патогенность Anisakis из-за их роли в биологических путях, связанных с фундаментальными взаимодействиями хозяин-патоген. Среди нескольких пептидаз, представленных в нашем наборе данных, мы идентифицировали металлоэндопептидазу (A0A3G5BC99), принадлежащую к семейству астациновых пептидаз M12A (код Pfam: Pf01400, секретируемые или прикрепленные к мембране протеазы, которым требуется цинк для катализа) и карбоксипептидазу (A0A158PN74), часть Peptidase_S10. семейство (Pf00450).Интересно, что оба семейства белков недавно были идентифицированы среди транскриптов с повышенной экспрессией в глотке A. simplex и Anisakis pegreffii [22]. Кроме того, было обнаружено, что уровень экспрессии мРНК металлоэндопептидазы выше у личинок A. simplex третьей стадии по сравнению с личинками четвертой стадии, что усиливает роль этого фермента как важного игрока в инвазии тканей хозяина [30].
5.
 Выводы
ВыводыНабор сигналов MALDI-TOF MS был идентифицирован как потенциальный консенсусный список пиков «биомаркеров», характеризующийся специфическими усредненными m/z и интенсивностью, для идентификации Anisakis spp.из личинок нематод, присутствующих в тканях пациентов, для улучшения существующих диагностических подходов. На самом деле, из-за схожести симптомов с обычными желудочно-кишечными расстройствами и отсутствия высококвалифицированных микроскопистов в биомедицинских лабораториях инфекция Anisakis часто недооценивается, а альтернативные диагностические инструменты вызывают зависть.
Кроме того, анализ снизу вверх белков Anisakis , полученных методом экстракции на основе набора MBT Sepsityper Kit и выполненный с помощью ЖХ-ИЭР-МС/МС на платформе высокого разрешения, подчеркнул наличие в экстракт нематоды, обогащенный рибосомными белками и специфическими белками, потенциально связанными с молекулярными механизмами, сопровождающими инфекцию.
Благодарности
Мы хотели бы поблагодарить A. Buchicchio (подразделение Daltonics Bruker Italia S.r.l.) за полезные советы.
Дополнительные материалы
Следующее доступно в Интернете по адресу https://www.mdpi.com/2073-4425/11/6/693/s1, Дополнительный материал S1: Список белков, идентифицированных с помощью LC-ESI-MS/MS ; Дополнительный материал S2: Список белков, идентифицированных с помощью LC-ESI-MS/MS и принадлежащих к таксономическому порядку Rhabditida; Дополнительный материал S3: Список белков Rhabditida, идентифицированных как минимум в четырех из пяти личинок образцов A и B LC , Дополнительный материал S4: Список белков Rhabditida, идентифицированных как минимум в четырех из пяти личинок образцов A и B LC и отфильтрованы путем объединения белков с одинаковыми именами в один хит и удаления неизвестных белков; Дополнительный материал S5: результаты преобразования ортологии генов; Дополнительный материал S6: Расширение функционального анализа.
Вклад авторов
Conceptualization, L.P.; Приобретение финансирования, LP; Следствие В. М., С. П. и Г. Ф.; Надзор, LP; Визуализация, В.М. и Г.Ф.; Написание — первоначальный вариант, В.М. и С.П.; Написание — обзор и редактирование, В.М., С.П., Г.Ф., С.Л.М., П.В., А.О.М. и L.P. Все авторы прочитали и согласились с опубликованной версией рукописи.
Финансирование
Это исследование финансировалось Fondazione Bambino Gesù, номер гранта 201903_SBG, и Ricerca Corrente министра здравоохранения Италии, номер гранта 201905_genetica, для L.P.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Литература
1. Nieuwenhuizen N.E., Lopata A.L. Аллергические реакции на анизакис, обнаруженные в рыбе. Курс. Allergy Asthma Rep. 2014; 14:455. doi: 10.1007/s11882-014-0455-3. [PubMed] [CrossRef] [Google Scholar]2. Ньювенхейзен Н.Э. Anisakis — Иммунология пищевого паразитоза. Иммунол от паразитов. 2016; 38: 548–557. doi: 10.1111/pim.12349. [PubMed] [CrossRef] [Google Scholar]3. Хохберг Н.С., Хамер Д.Х. Анисакидоз: опасности глубин. клин. Заразить. Дис. 2010; 51:806–812. дои: 10.1086/656238. [PubMed] [CrossRef] [Google Scholar]4. Путиньяни Л., Дель Кьерико Ф., Онори М., Манчинелли Л., Арджентьери М., Бернаски П., Колтелла Л., Лучиньяно Б., Пансани Л., Ранно С. и др. Масс-спектрометрия MALDI-TOF, протеомное фенотипирование клинически значимых грибов. Мол. Биосист. 2011;7:620–629. doi: 10.1039/C0MB00138D. [PubMed] [CrossRef] [Google Scholar]5. Дель Кьерико Ф., Масотти А., Онори М., Фискарелли Э., Манчинелли Л., Риччиотти Г., Альгизи Ф., Димициани Л., Манетти К., Урбани А. и др. MALDI-TOF MS протеомное фенотипирование мицелиальных и других грибов клинического происхождения. Дж. Протеом. 2012;75:3314–3330. doi: 10.1016/j.jprot.2012.03.048. [PubMed] [CrossRef] [Google Scholar]6. Дель Кьерико Ф., Петрукка А., Верноччи П., Бракалья Г., Фискарелли Э., Бернаски П., Мурака М., Урбани А., Путиньяни Л. Протеомика способствует развитию трансляционной и клинической микробиологии.
doi: 10.1111/pim.12349. [PubMed] [CrossRef] [Google Scholar]3. Хохберг Н.С., Хамер Д.Х. Анисакидоз: опасности глубин. клин. Заразить. Дис. 2010; 51:806–812. дои: 10.1086/656238. [PubMed] [CrossRef] [Google Scholar]4. Путиньяни Л., Дель Кьерико Ф., Онори М., Манчинелли Л., Арджентьери М., Бернаски П., Колтелла Л., Лучиньяно Б., Пансани Л., Ранно С. и др. Масс-спектрометрия MALDI-TOF, протеомное фенотипирование клинически значимых грибов. Мол. Биосист. 2011;7:620–629. doi: 10.1039/C0MB00138D. [PubMed] [CrossRef] [Google Scholar]5. Дель Кьерико Ф., Масотти А., Онори М., Фискарелли Э., Манчинелли Л., Риччиотти Г., Альгизи Ф., Димициани Л., Манетти К., Урбани А. и др. MALDI-TOF MS протеомное фенотипирование мицелиальных и других грибов клинического происхождения. Дж. Протеом. 2012;75:3314–3330. doi: 10.1016/j.jprot.2012.03.048. [PubMed] [CrossRef] [Google Scholar]6. Дель Кьерико Ф., Петрукка А., Верноччи П., Бракалья Г., Фискарелли Э., Бернаски П., Мурака М., Урбани А., Путиньяни Л. Протеомика способствует развитию трансляционной и клинической микробиологии. Дж. Протеом. 2014;97:69–87. doi: 10.1016/j.jprot.2013.10.013. [PubMed] [CrossRef] [Google Scholar]7. Греко В., Пирас К., Пьерони Л., Рончи М., Путиньяни Л., Ронкада П., Урбани А. Применение масс-спектрометрии MALDI-TOF в клинической протеомике. Эксперт Преподобный Протеом. 2018;15:683–696. doi: 10.1080/14789450.2018.1505510. [PubMed] [CrossRef] [Google Scholar]8. Муругаян Дж., Реслер У. MALDI-TOF MS Profiling – достижения в видовой идентификации вредителей, паразитов и переносчиков. Фронт. Клетка. Заразить. микробиол. 2017;7:184. doi: 10.3389/fcimb.2017.00184. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]9. Feucherolles M., Poppert S., Utzinger J., Becker S.L. Масс-спектрометрия MALDI-TOF как диагностический инструмент в гельминтологии человека и ветеринарии: систематический обзор. Векторы паразитов. 2019;12:245. doi: 10.1186/s13071-019-3493-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]10. Нагорный С.А., Алешукина А.В., Алешукина И.С., Ермакова Л.А., Пшеничная Н.
Дж. Протеом. 2014;97:69–87. doi: 10.1016/j.jprot.2013.10.013. [PubMed] [CrossRef] [Google Scholar]7. Греко В., Пирас К., Пьерони Л., Рончи М., Путиньяни Л., Ронкада П., Урбани А. Применение масс-спектрометрии MALDI-TOF в клинической протеомике. Эксперт Преподобный Протеом. 2018;15:683–696. doi: 10.1080/14789450.2018.1505510. [PubMed] [CrossRef] [Google Scholar]8. Муругаян Дж., Реслер У. MALDI-TOF MS Profiling – достижения в видовой идентификации вредителей, паразитов и переносчиков. Фронт. Клетка. Заразить. микробиол. 2017;7:184. doi: 10.3389/fcimb.2017.00184. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]9. Feucherolles M., Poppert S., Utzinger J., Becker S.L. Масс-спектрометрия MALDI-TOF как диагностический инструмент в гельминтологии человека и ветеринарии: систематический обзор. Векторы паразитов. 2019;12:245. doi: 10.1186/s13071-019-3493-9. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]10. Нагорный С.А., Алешукина А.В., Алешукина И.С., Ермакова Л.А., Пшеничная Н. Ю. Применение протеомных методов (MALDI-toff MS) для изучения белковых профилей некоторых нематод (дирофилярий и аскарид) для дифференциации видов.Междунар. Дж. Заразить. Дис. 2019;82:61–65. doi: 10.1016/j.ijid.2019.02.047. [PubMed] [CrossRef] [Google Scholar] 11. Дистлер У., Кухарев Дж., Наварро П., Тенцер С. Количественная оценка без меток в протеомике сбора данных с повышенной ионной подвижностью. Нац. протокол 2016; 11: 795–812. doi: 10.1038/nprot.2016.042. [PubMed] [CrossRef] [Google Scholar] 13. Рейманд Дж., Арак Т., Адлер П., Колберг Л., Рейсберг С., Петерсон Х., Вило Дж. g:Profiler — веб-сервер для функциональной интерпретации списков генов (обновление 2016 г.) Nucleic Acids Res.2016;44:W83–W89. doi: 10.1093/nar/gkw199. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]15. Шклярчик Д., Гейбл А.Л., Лайон Д., Юнге А., Видер С., Уэрта-Сепас Дж., Симонович М., Дончева Н.Т., Моррис Дж.Х., Борк П. и др. STRING v11: Сети межбелковых ассоциаций с увеличенным охватом, поддерживающие функциональные открытия в полногеномных экспериментальных наборах данных.
Ю. Применение протеомных методов (MALDI-toff MS) для изучения белковых профилей некоторых нематод (дирофилярий и аскарид) для дифференциации видов.Междунар. Дж. Заразить. Дис. 2019;82:61–65. doi: 10.1016/j.ijid.2019.02.047. [PubMed] [CrossRef] [Google Scholar] 11. Дистлер У., Кухарев Дж., Наварро П., Тенцер С. Количественная оценка без меток в протеомике сбора данных с повышенной ионной подвижностью. Нац. протокол 2016; 11: 795–812. doi: 10.1038/nprot.2016.042. [PubMed] [CrossRef] [Google Scholar] 13. Рейманд Дж., Арак Т., Адлер П., Колберг Л., Рейсберг С., Петерсон Х., Вило Дж. g:Profiler — веб-сервер для функциональной интерпретации списков генов (обновление 2016 г.) Nucleic Acids Res.2016;44:W83–W89. doi: 10.1093/nar/gkw199. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]15. Шклярчик Д., Гейбл А.Л., Лайон Д., Юнге А., Видер С., Уэрта-Сепас Дж., Симонович М., Дончева Н.Т., Моррис Дж.Х., Борк П. и др. STRING v11: Сети межбелковых ассоциаций с увеличенным охватом, поддерживающие функциональные открытия в полногеномных экспериментальных наборах данных. Нуклеиновые Кислоты Res. 2019;47:D607–D613. doi: 10.1093/nar/gky1131. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]16. Стрыинский Р., Матеос Дж., Паскуаль С., Гонсалес А.Ф., Галлардо Дж.М., Лопеньска-Бернат Э., Медина И., Каррера М. Профилирование протеома стадий развития L3 и L4 Anisakis simplex с помощью количественной протеомики на основе ТМТ. Дж. Протеом. 2019; 201:1–11. doi: 10.1016/j.jprot.2019.04.006. [PubMed] [CrossRef] [Google Scholar] 17. Холмс Д.Т., Ромни М.Г., Энджел П., Демарко М.Л. Протеомные приложения в патологии и лабораторной медицине: современное состояние и перспективы на будущее. клин. Биохим. 2020:S00090300813. doi: 10.1016/j.клинбиохим.2020.05.007. [PubMed] [CrossRef] [Google Scholar] 18. Джедди Ф., Япо-Куадио Г.К., Норманд А.-К., Кассань К., Марти П., Пиарру Р. Оценка эффективности двух методов лизиса для прямой идентификации дрожжей из клинических культур крови с использованием масс-спектрометрии MALDI-TOF. Мед. Мико. 2017;55:185–192. doi: 10.
Нуклеиновые Кислоты Res. 2019;47:D607–D613. doi: 10.1093/nar/gky1131. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]16. Стрыинский Р., Матеос Дж., Паскуаль С., Гонсалес А.Ф., Галлардо Дж.М., Лопеньска-Бернат Э., Медина И., Каррера М. Профилирование протеома стадий развития L3 и L4 Anisakis simplex с помощью количественной протеомики на основе ТМТ. Дж. Протеом. 2019; 201:1–11. doi: 10.1016/j.jprot.2019.04.006. [PubMed] [CrossRef] [Google Scholar] 17. Холмс Д.Т., Ромни М.Г., Энджел П., Демарко М.Л. Протеомные приложения в патологии и лабораторной медицине: современное состояние и перспективы на будущее. клин. Биохим. 2020:S00090300813. doi: 10.1016/j.клинбиохим.2020.05.007. [PubMed] [CrossRef] [Google Scholar] 18. Джедди Ф., Япо-Куадио Г.К., Норманд А.-К., Кассань К., Марти П., Пиарру Р. Оценка эффективности двух методов лизиса для прямой идентификации дрожжей из клинических культур крови с использованием масс-спектрометрии MALDI-TOF. Мед. Мико. 2017;55:185–192. doi: 10. 1093/mmy/myw038. [PubMed] [CrossRef] [Google Scholar] 19. Кайин М., Мерт Б., Айдемир С., Озенчи В. Сравнение быстрого набора BACpro® II, набора Sepsityper® и внутренних методов подготовки для прямой идентификации бактерий из культур крови методом MALDI-TOF MS с модулем Sepsityper® и без него анализ.Евро. Дж. Клин. микробиол. Заразить. Дис. 2019;38:2133–2143. doi: 10.1007/s10096-019-03654-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]20. Люти П.М., Джонсон Дж.К. Использование времяпролетной масс-спектрометрии с лазерной десорбцией/ионизацией с матрицей (MALDI-TOF MS) для идентификации патогенов, вызывающих сепсис. Дж. Заявл. лаборатория Мед. 2019;3:675–685. doi: 10.1373/jalm.2018.027318. [PubMed] [CrossRef] [Google Scholar] 21. Рыжов В., Фенселау К. Характеристика субпопуляции белков, десорбированных методом MALDI из цельных бактериальных клеток.Анальный. хим. 2001; 73: 746–750. doi: 10.1021/ac0008791. [PubMed] [CrossRef] [Google Scholar] 22. Кавальеро С., Ломбардо Ф., Су Х.
1093/mmy/myw038. [PubMed] [CrossRef] [Google Scholar] 19. Кайин М., Мерт Б., Айдемир С., Озенчи В. Сравнение быстрого набора BACpro® II, набора Sepsityper® и внутренних методов подготовки для прямой идентификации бактерий из культур крови методом MALDI-TOF MS с модулем Sepsityper® и без него анализ.Евро. Дж. Клин. микробиол. Заразить. Дис. 2019;38:2133–2143. doi: 10.1007/s10096-019-03654-4. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]20. Люти П.М., Джонсон Дж.К. Использование времяпролетной масс-спектрометрии с лазерной десорбцией/ионизацией с матрицей (MALDI-TOF MS) для идентификации патогенов, вызывающих сепсис. Дж. Заявл. лаборатория Мед. 2019;3:675–685. doi: 10.1373/jalm.2018.027318. [PubMed] [CrossRef] [Google Scholar] 21. Рыжов В., Фенселау К. Характеристика субпопуляции белков, десорбированных методом MALDI из цельных бактериальных клеток.Анальный. хим. 2001; 73: 746–750. doi: 10.1021/ac0008791. [PubMed] [CrossRef] [Google Scholar] 22. Кавальеро С., Ломбардо Ф., Су Х. , Сальвемини М., Кантасесси С., Д’Амелио С. Тканеспецифические транскриптомы Anisakis simplex (sensu stricto) и Anisakis pegreffii раскрывают потенциальные молекулярные механизмы, участвующие в патогенности. Векторы паразитов. 2018;11:31. doi: 10.1186/s13071-017-2585-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23. Мари А., Раси К., Палаццо П., Скала Э. Базы данных аллергенов: текущее состояние и перспективы.Курс. Allergy Asthma Rep. 2009; 9:376–383. doi: 10.1007/s11882-009-0055-9. [PubMed] [CrossRef] [Google Scholar] 24. Айбину И.Е., Смукер П.М., Лопата А.Л. Нематоды Anisakis в рыбе и моллюсках – от инфекции к аллергии. Междунар. Дж. Паразитол. Паразиты Wildl. 2019;9:384–393. doi: 10.1016/j.ijppaw.2019.04.007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]25. Audicana MT, Kennedy MW Anisakis simplex: от малоизвестного инфекционного червя до индуктора иммунной гиперчувствительности. CMR. 2008; 21: 360–379.doi: 10.1128/CMR.00012-07. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26.
, Сальвемини М., Кантасесси С., Д’Амелио С. Тканеспецифические транскриптомы Anisakis simplex (sensu stricto) и Anisakis pegreffii раскрывают потенциальные молекулярные механизмы, участвующие в патогенности. Векторы паразитов. 2018;11:31. doi: 10.1186/s13071-017-2585-7. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]23. Мари А., Раси К., Палаццо П., Скала Э. Базы данных аллергенов: текущее состояние и перспективы.Курс. Allergy Asthma Rep. 2009; 9:376–383. doi: 10.1007/s11882-009-0055-9. [PubMed] [CrossRef] [Google Scholar] 24. Айбину И.Е., Смукер П.М., Лопата А.Л. Нематоды Anisakis в рыбе и моллюсках – от инфекции к аллергии. Междунар. Дж. Паразитол. Паразиты Wildl. 2019;9:384–393. doi: 10.1016/j.ijppaw.2019.04.007. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]25. Audicana MT, Kennedy MW Anisakis simplex: от малоизвестного инфекционного червя до индуктора иммунной гиперчувствительности. CMR. 2008; 21: 360–379.doi: 10.1128/CMR.00012-07. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]26. Кобаяси Ю., Исидзаки С., Шимакура К., Нагасима Ю., Сиоми К. Молекулярное клонирование и экспрессия двух новых аллергенов Anisakis simplex. Паразитол. Рез. 2007; 100:1233–1241. doi: 10.1007/s00436-006-0396-4. [PubMed] [CrossRef] [Google Scholar] 27. Гарсия-Майораль М.Ф., Тревиньо М.А., Перес-Пиньяр Т., Кабальеро М.Л., Кнауте Т., Умпьеррес А., Бруикс М., Родригес-Перес Р. Взаимоотношения между эпитопами IgE/IgG4, структура и функция в Anisakis simplex Ani s 5 , член семейства белков SXP/RAL-2.PLoS Негл. Троп. Дис. 2014;8:e2735. doi: 10.1371/journal.pntd.0002735. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]28. Мердана Ф., Бухманн К. Экскреторные/секреторные продукты анизакидных нематод: биологическая и патологическая роль. Акта Вет. Сканд. 2017;59:42. doi: 10.1186/s13028-017-0310-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]29. Лопеньска-Бьернат Э., Стрыйньски Р., Дмитриюк М., Василевска Б. Инфекционные личинки Anisakis simplex (Nematoda) накапливают трегалозу и гликоген в ответ на голодание и температурный стресс.
Кобаяси Ю., Исидзаки С., Шимакура К., Нагасима Ю., Сиоми К. Молекулярное клонирование и экспрессия двух новых аллергенов Anisakis simplex. Паразитол. Рез. 2007; 100:1233–1241. doi: 10.1007/s00436-006-0396-4. [PubMed] [CrossRef] [Google Scholar] 27. Гарсия-Майораль М.Ф., Тревиньо М.А., Перес-Пиньяр Т., Кабальеро М.Л., Кнауте Т., Умпьеррес А., Бруикс М., Родригес-Перес Р. Взаимоотношения между эпитопами IgE/IgG4, структура и функция в Anisakis simplex Ani s 5 , член семейства белков SXP/RAL-2.PLoS Негл. Троп. Дис. 2014;8:e2735. doi: 10.1371/journal.pntd.0002735. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]28. Мердана Ф., Бухманн К. Экскреторные/секреторные продукты анизакидных нематод: биологическая и патологическая роль. Акта Вет. Сканд. 2017;59:42. doi: 10.1186/s13028-017-0310-3. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]29. Лопеньска-Бьернат Э., Стрыйньски Р., Дмитриюк М., Василевска Б. Инфекционные личинки Anisakis simplex (Nematoda) накапливают трегалозу и гликоген в ответ на голодание и температурный стресс. биол. Открытым. 2019; 8 doi: 10.1242/bio.040014. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]30. Ким Дж.-Х., Ким Дж.-О., Чон Ч.-Х., Нам У.-Х., Субраманиям С., Ю С.-И., Пак Дж.-Х. Сравнительный транскриптомный анализ личинок третьей и четвертой стадий Anisakis simplex (Nematoda: Anisakidae) Mol. Биохим. Паразитол. 2018; 226:24–33. doi: 10.1016/j.molbiopara.2018.10.002. [PubMed] [CrossRef] [Google Scholar]
биол. Открытым. 2019; 8 doi: 10.1242/bio.040014. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar]30. Ким Дж.-Х., Ким Дж.-О., Чон Ч.-Х., Нам У.-Х., Субраманиям С., Ю С.-И., Пак Дж.-Х. Сравнительный транскриптомный анализ личинок третьей и четвертой стадий Anisakis simplex (Nematoda: Anisakidae) Mol. Биохим. Паразитол. 2018; 226:24–33. doi: 10.1016/j.molbiopara.2018.10.002. [PubMed] [CrossRef] [Google Scholar]Список хэшей для ‘5292053e3616ec74613bd3032519460b5a93d396’
ccfa74c7d64bb4e750f2fb98a254f4514a1ee3302ef626ba8976405f 9020 3 3e0e6ccb25b981bb54f3c0d977bdcd4ca3fc9a5340323888 af179b45364c33370f0da531813fc2d15c7f4abb09d01882 c4d332c319a2499feb263b0adf5cc8fab0effdc7a98ed93b| md2 | e4242e85384492421426acd8af042c9a | |
| md4 | b3f994a6aac13c5ed3f2370ea50ad816 | |
| md5 | 24e3e33e065dba177ca50da4bfab5a9a | |
| sha1 | 30386432e63877fb9a426cdcc8b6c02ea977ba3c | |
| sha224 a0bc77ea6d23fdcbb8188bb5c2858909f67b461c5d0d01535d79f591 | ||
| sha256 c27e0f41a17927629f91e1ec6b35bb5a1cd0f14a3971f42cfc6cadf16242b63c | ||
| SHA384 d9019d6a492828ea654e4450608fd178c485c1005eb8cd120017c4663f83b56d30d581c1982f096796ba 6cad9dc | ||
| SHA512 / 224 | ||
| SHA512 / 256 | b3823bfd450d9c28b991e7d59d8ef6da1e090aba3b51f22ca9e06e 317d5 | |
| SHA512 da2ffbdfe59 | 3e86a9ee9c885216957c7abc9051cc9247d614f2dc44a41fc7299dbe4bcdf98919f020268960f688b2fce3622f5117138b4c027f3489caeb | |
| sha3-224 62dc026927c42ae5f064c3951647373e66ac98a340ed8e11b497d3e8 | ||
| sha3-256 6b683200986b1003bae27ef3abe67771e7c45e2230d1a91ad2a226f44177bec6 | ||
| sha3-384 fd09993203d21c102f079ef8efa241307a3954119a1c10be688beb949800d7661e8d7c50b2308c9cb7c24efccd75747c | ||
| sha3-512 da4f234575606844c76f4c2d145a1da9affae2ec80fa8453310fb405cc720e480120d786ac6e1b78e99fcbbb6dc3a166a91cd9b3d92f053425187995e6769fdb | ||
| ripemd128 79b99666e8f79c05c79a3b26934437b7 | ||
| ripemd160 ec6e18c6aad9fe7546c8f2f579c2a1afa38d35e6 | ||
| ripemd256 f8569936d3553d995fa27cfcdb40c9ad2d3de19b649d6ca9a8 e811ce84338001 | ||
| ripemd320 68b7483fe2ab384bf98590c3427489b4c9b4fb5cc30622d944953b2d63cd37eff6e47c5398bc5204 | ||
| вихревая e6a316861cd4e792dbf3edd57bc5c281ba85afba29b03f60b80da2e5684c1a534668174f02a79e4a66b3ed3c9727ca3c5be25ae10ccbab72d5398218bb175fd0 | ||
| tiger128,3 329a992035ecb9fa2720c6326c9690b6 | ||
| tiger160,3 329a992035ecb9fa2720c6326c9690b67c23c0ba | ||
| tiger192,3 329a992035ecb9fa2720c6326c9690b67c23c0ba01a310bd | ||
| tiger128,4 | b10ebd0b84226c30264a5ce036a557ef | |
| tiger160,4 b10ebd0b84226c30264a5ce036a557ef6ad66190 | ||
| tiger192,4 b10ebd0b84226c30264a5ce036a557ef6ad66190cd0a2405 | ||
| Snefru eabd7318ef838378c9b3e2b847f047f89b46ca518028acde292f54ce59e99a84 | ||
| snefru256 | eabd7318ef838378c9b3e2b847f047f89b46ca518028acde292f54ce59e99a84 | |
| гост | 873d12ab68b849c825f2f875fb8d5b4e2c941bb5149fa8b50ff0a5fcb24ee6f2 | |
| гост-Crypto | 2930bb18e9ccde88861834f3c18537f4d41a1fbd3dad738578907fd18e4a1cca | |
| adler32 | c20b099e | |
| CRC32 | 0fe84464 | |
| crc32b | ec399c21 | |
| fnv132 86994336 | ||
| fnv1a32 51e25874 | ||
| fnv164 dbf72ccc864c5856 | ||
| fnv1a64 a69c927b6cf6b534 | ||
| joaat 86cefb59 | ||
| haval128,3 6dbf58a9ca3644c5ee416fb150a579d1 | ||
| haval160,3 | 73091f1d7882a5a9fae28b32a0fc3448c0ddc322 | |
| ч aval192,3 | ||
| haval224,3 cfcf55080493685e3dc80df30298313940ae2b2f61fa2eb3498020ac | ||
| haval256,3 792d3b9f1d42852fd251f640766d8fc847b9f6d0a58011d5ad8d381821957add | ||
| haval128,4 dda9ca4b4a6c923088cf0b57325a2ce8 | ||
| haval160,4 ffc44c075d8bd71e51eb8f8199d2f6b172a58836 | ||
| haval192,4 | ||
| haval224,4 534db45bc21acbe9aeeda75069a6834514e3ff001e64e1c2631058b8 | ||
| haval256,4 ceddad5d8dc7ec470e89361d089342516ef218901b54cb86c065f2c8fe9c7bf7 | ||
| haval128,5 50eb82fad10e5189bf6dd2ce4c56b77e | ||
| haval160,5 cb6b990b25b85c07f7312543f18c4200427ab055 | ||
| час aval192,5 | ||
| haval224,5 aa79f79e6e28ac8226dd5f5a227c637efecfad8caec40c85f337241d | ||
| haval256,5 b4ea44bd3888d5890a849b204e3115fdfbd1a051efc11d5fc613bc4fbbd5df0d |
(PDF) Сибирь и Дальний Восток России Будущее Производство древесины: Анализ.

84
Таблица 2. Прогнозируемый объем древостоя на лесных землях по классам эксплуатации, все проанализированные сценарии управления,
и год для Сибири и Дальнего Востока России, продолжение.
Без изменений Увеличение
Восточный лес No В Mangement Увеличение Экологии Увеличение Регенерация
Сибирь Эксплуатация (Базовая линия) Регенерация Ограничения Ограничения и защита
2008 Обсуждаемая (тыс. Кубометров)
сосна 3930,139 3,423 581 3 388 316 3,385,783 3408718 3 374712
884240 755939 759233 775945 754478 762282
пихты 1316091 1211545 1213443 1236664 1209168 1212864
Лиственница 4883602 4307889 4300848 4375383 4296806 4284519
Cedar 1396361 1413970 1414359 1411747 1414213 1414439
Birch 1496935 1264101 1243484 1234181 1254826 1246871
Aspen 471.462 359.858 363.834 364.437 369.472 363,218
Прочие лиственных 1 017 1,017 784 816 922 1,016
субтом 14 379846 12 737 899 8846 12 737 899 12 684 300 12 784 955 12 708 603 12 659 920
2008 г. Не существует
Не существует
PI пе 1783773 1783773 1783773 1783773 1783773 1783773
Spruce 1136303 1136303 1136303 1136303 1136303 1136303
пихты 504752 504752 504752 504752 504752 504752
Лиственница 88 88 88 88 88 88
Cedar 3408486 3408486 3408486 3408486 3408486 3408486
Birch 807.280 807.280 807.280 807.280 807280 807280
Aspen 118757 118757 118757 118757 118757 118757
Другие лиственные 2542 2542 2542 2542 2542 2542
East Итого 16668162 16668162 16668162 16668162 16668162 16668162
Сибирь 2008 общая 31048009 29406062 29352462 29453118 29376766 29328082
2028 уязвимостям
Pine 4130242 3,242,307 3,258,026 3,274 690 3,231,484 3,240,031
ели 1 046 290 746 825 751 583 76 1825 751 583 761 015 749 211 746 335
ель 1 367 70007 1 208 842 1 211 767 1 245 390 1,212,40 7 1214192
Лиственница 5068555 4117393 4118222 4258245 4094417 4122779
Cedar 1618273 1463056 1463594 1479724 1468143 1461133
Birch 1423173 1328454 1277809 1250801 1335724 12
Aspen 440772 418263 399140 385326 414575 400191
Другие лиственные +1030 340 185 292 375 164
Итого 15096042 12525480 12480326 12655482 12506336 12476257
2028 Nonexploitable
Сосна 1803808 1803808 1803808 1803808 1807375 1807375
Spruce 1285602 1285602 1285602 1285602 1287476 1287476
пихты 562884 562884 562884 562884 564019 564019
Лиственница 8852910 8852910 8852910 8852910 8865660 8865660
Cedar 3,512,390 3,512,312,312,390 3512,390 3,5190 3512,390 3,519,841 3519 841
Birch 747 589 747 589 747 589 747 589 747 589 747 589 748 308 748 308
Aspen 109 161 109 1611016161 109 161 109 270 109270
Другие лиственные 2587 2587 2587 2587 2589 2589
East Итого 16876931 16876931 16876931 16876931 161 161
Сибирь 2028 общая 31972973 29402411 29357257 29532414 29410877 29380798
2068 уязвимостям
Сосна 4181988 3092649 3415843 3557290 3097125 3405768
Spruce 1247040 813171 800220 795909 819690 793499
пихты 1400266 1262868 1260641 1295937 1273367 1267057
Лиственница 5305070 4083191 4163664 4326437 4102796 4219670
Cedar 1981288 1604480 1599652 1625852 1624768 1610162
Birch 1209930 1357742 1072990 1014526 1360595 1089176
Aspen 3 417385 340250 324757 429585 345300
Прочие лиственные 1,017 768 227 201 783 222
Сосна 1842309 1842309 1842309 1842309 1862871 1862871
Spruce 1385027 1385027 1385027 1385027 1397386 1397386
пихты 645077 645077 645077 645077 652013 652013
Лиственница 8813993 8813993 8813993 8813993 8887767 8887767
Cedar 3605795 3605795 3605795 3605795 3652806 3652806
Birch 758345 758345 758.

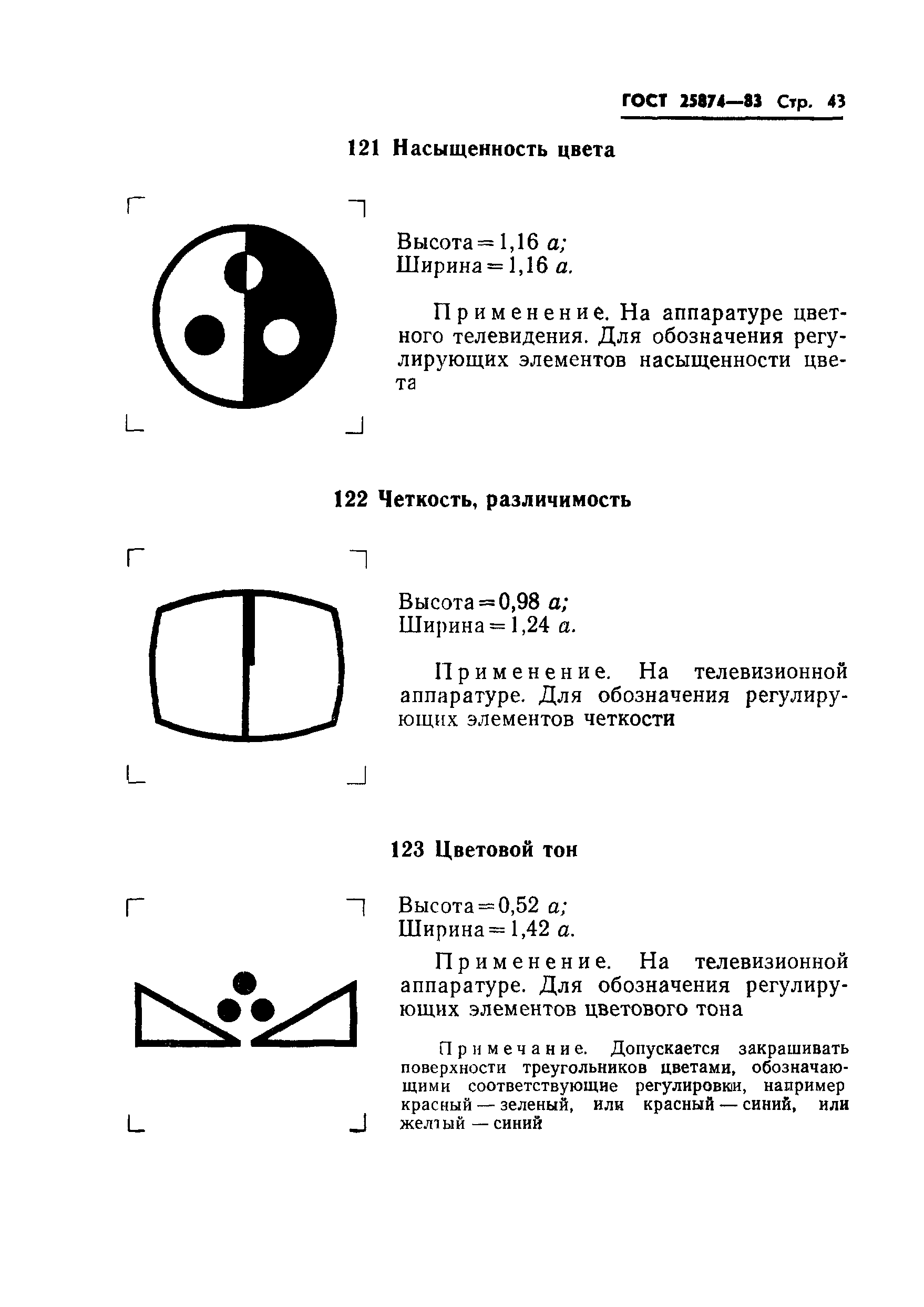


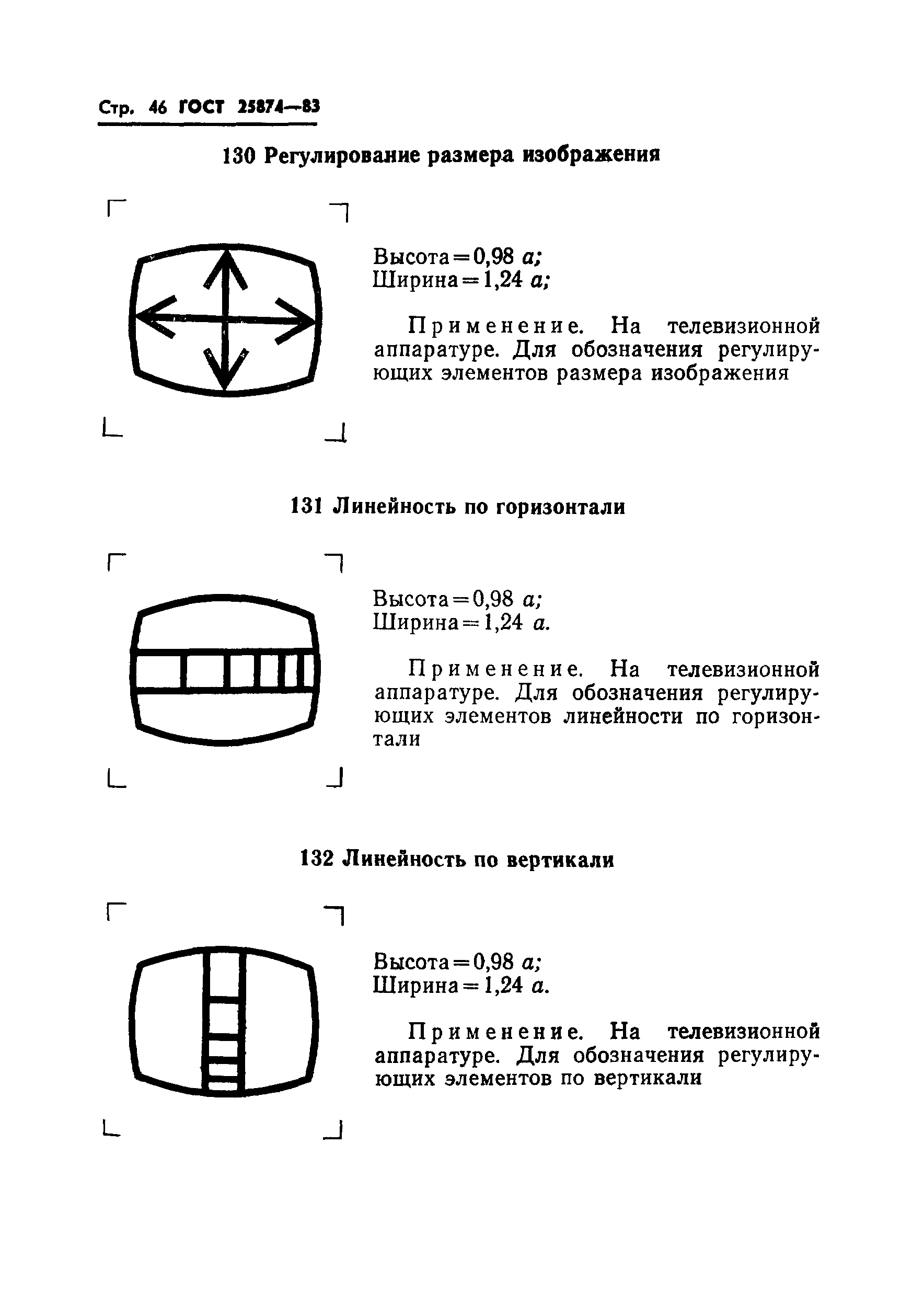

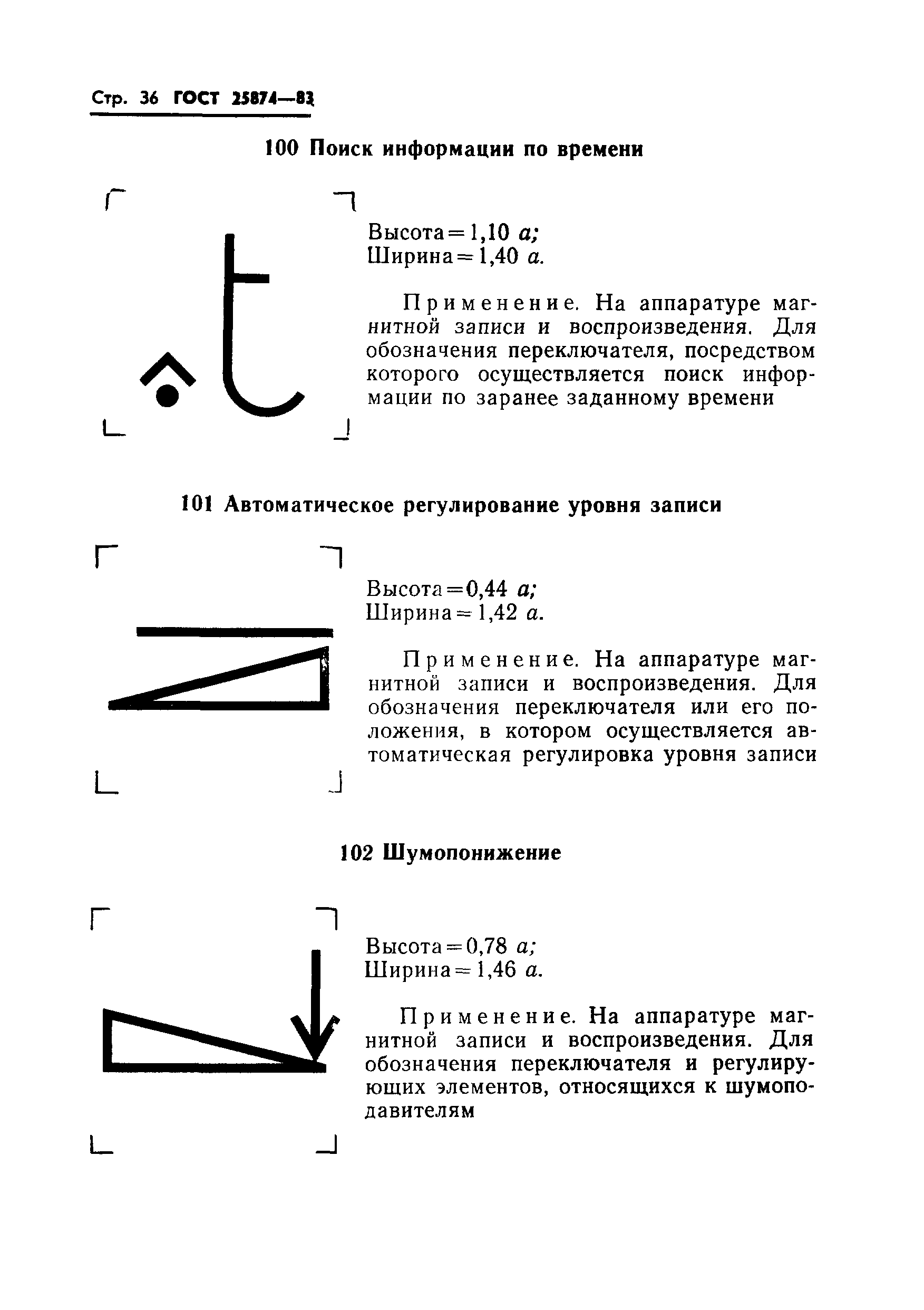
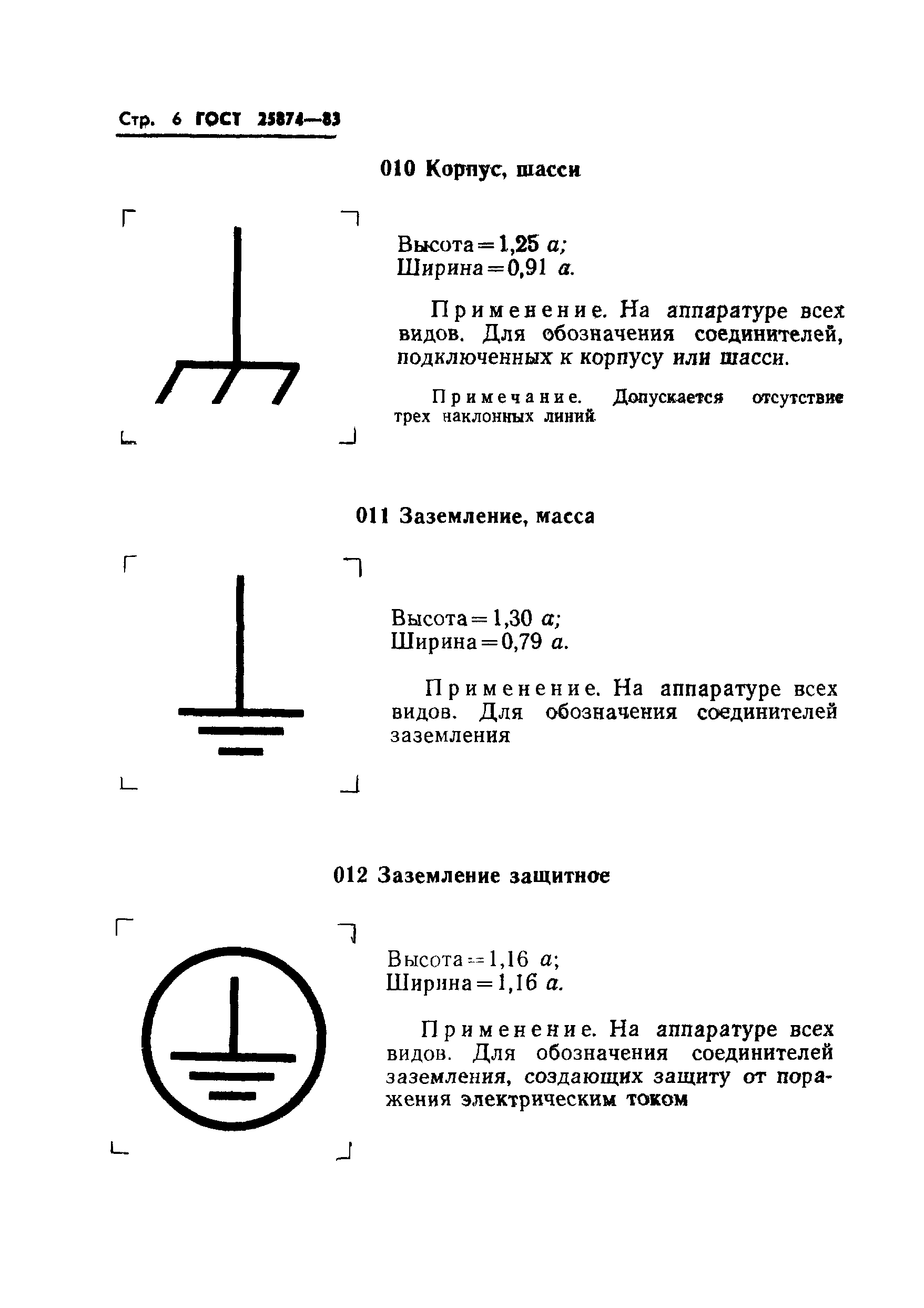
 В телефонии на несущей частоте категория модулятора может указываться путем внесения штрихов в левый верхний угол обозначения, как это показано на примерах:
В телефонии на несущей частоте категория модулятора может указываться путем внесения штрихов в левый верхний угол обозначения, как это показано на примерах: