Мдс 81 35: МДС 81-35.2004 (актуальная редакция на 2018)
Утверждена новая методика определения сметной стоимости
Приказом Минстроя России от 04.08.2020 №421/пр «Об утверждении Методики определения сметной стоимости строительства, реконструкции, капитального ремонта, сноса объектов капитального строительства, работ по сохранению объектов культурного наследия (памятников истории и культуры) народов Российской Федерации на территории Российской Федерации» утверждена новая Методика определения сметной стоимости строительства реконструкции, капитального ремонта, сноса объектов капитального строительства, работ по сохранению объектов культурного наследия.
Методика введена вместо методики МДС 81-35.2004. Она определяет единые методы формирования сметной стоимости строительства, реконструкции капремонта и сноса объектов капительного строительства на этапе проектирования.
Положения Методики применяются к объектам, финансируемым с привлечением средств бюджетов бюджетной системы РФ и госкомпаний.
Новой Методикой введены ряд важных изменений в порядок определения сметной стоимости строительства:
— Изменена структура локальных сметных расчетов. В соответствии с новой Методикой позиция сметного расчета – это составной элемент, состоящий из единичной расценки и связанных с ней неучтенных материальных ресурсов. Изменен порядок формирования итогов по позициям локальной сметы.
— Изменен порядок применения и округления результатов вычисления поправочных коэффициентов к стоимостным и количественным показателям локальной сметы.
Коэффициенты, учитывающие усложняющие факторы и условия производства работ, применяются одновременно с другими коэффициентами в порядке, установленном Методикой. При одновременном применении коэффициенты перемножаются, результат округляется до семи знаков после запятой.
— Введены новые варианты применения индексов перевода в текущий уровень цен. Обязательным условием применения индексов является их включение в ФРСН. Изменена структура итогов локального сметного расчета.
Обязательным условием применения индексов является их включение в ФРСН. Изменена структура итогов локального сметного расчета.
— Изменена структура итогов объектной сметы. Введена необходимость отображения в итогах объектной сметы данных по элементам прямых затрат, накладным расходам, сметной прибыли, стоимости оборудования и транспортной перевозки.
— Изменены печатные формы документов. Введена новая структура документов, печатные формы дополнены графами и полями для вывода дополнительных данных. Введен новый порядок заполнения печатных форм.
МДС 81-35.2004 Методика определения стоимости строительной продукции на территории российской федерации
Методика определения стоимости строительной продукции на территории Российской Федерации (далее — Методика) разработана в соответствии с действующим законодательством Российской Федерации на основе методических и нормативных документов, предусмотренных сметно-нормативной базой ценообразования в строительстве 2001 года.
Методика имеет в своем составе общие методические положения по составлению сметной документации и определению сметной стоимости строительства, выполнения ремонтных, монтажных и пусконаладочных работ на всех стадиях разработки предпроектной и проектной документации, формированию договорных цен на строительную продукцию .и проведению расчетов за выполненные работы. В Методике освещены основные положения по применению элементных сметных норм и расценок, а также лимитированных и. прочих работ и затрат, предусмотренных сметно-нормативной базой ценообразования в строительстве 2001 года.
В Методике учтены требования и положения нормативных правовых методических документов по состоянию на 1 марта 2004 г.
В соответствии с поручением Правительства Российской Федерации от 27.11.2003 № ВЯ-П10-14161 положения, приведенные в Методике распространяются на все предприятия строительного комплекса Российской Федерации при определении стоимости строительства новых, реконструкции, расширения и технического перевооружения действующих предприятий, зданий и сооружений, выполнения ремонтных и пусконаладочных работ вне зависимости от источников финансирования, осуществляемых на территории Российской Федерации, а также при формировании цен на строительную продукцию и расчетах за выполненные работы.
Разногласия по вопросам применения сметных нормативов подлежат рассмотрению уполномоченным федеральным органом исполнительной власти в области строительства.
Настоящая Методика предназначена для определения стоимости строительства новых, реконструкции, расширения и технического перевооружения действующих предприятий, зданий и сооружений, выполнения ремонтных и пусконаладочных работ (далее строительства), осуществляемого на территории Российской Федерации, а также формирования цен на строительную продукцию.
Положения, приведенные в Методике, рекомендуются для использования организациями, независимо от ведомственной принадлежности и форм собственности, осуществляющими строительство с привлечением средств государственного бюджета всех уровней и государственных внебюджетных фондов, а также внебюджетных источников финансирования.
Положения настоящей Методики могут применяться также при определении стоимости реставрационных работ.
Документ, заменяющий МДС 81-35.
 2004.
2004.15 марта 2018 года был опубликован знаковый документ, а именно ПРОЕКТ «Методики определения стоимости строительной продукции на территории Российской Федерации» – аналог действующего МДС 81-35.2004.
Документ на заключительном этапе: «Завершение разработки проекта нормативного правового акта. Формирование окончательного варианта текста проекта нормативного правового акта.»
Методика определения стоимости строительной продукции на территории Российской Федерации (далее — Методика) предназначена для определения сметной стоимости строительства, реконструкции, капитального ремонта объектов капитального строительства, финансируемого с привлечением средств бюджетов бюджетной системы Российской Федерации, средств юридических лиц, созданных Российской Федерацией, субъектами Российской Федерации, муниципальными образованиями, юридических лиц, доля в уставных (складочных) капиталах которых Российской Федерации, субъектов Российской Федерации, муниципальных образований составляет более 50 процентов, а также сметной стоимости капитального ремонта многоквартирного дома (общего имущества в многоквартирном доме), осуществляемого полностью или частично за счет средств регионального оператора, товарищества собственников жилья, жилищного, жилищно-строительного кооператива или иного специализированного потребительского кооператива либо средств собственников помещений в многоквартирном доме.
В иных случаях положения Методики носят рекомендательный характер и применяются, если это определено федеральным законом или договором.
Методика определяет единый порядок формирования сметной стоимости строительства, реконструкции, капитального ремонта объектов капитального строительства (далее — строительство) при планировании (обосновании) инвестиций (капитальных вложений) в объекты капитального строительства и при подготовке проектной (иной технической) документации.
Проектом признается утратившим силу Постановление Госстроя России№15/1 от 05.03.2004 года «Об утверждении и введении в действие Методики определения стоимости строительной продукции на территории Российской Федерации» (МДС 81−35.2004).
Проект приказа предусматривает введение методики в действие по истечении 100 дней со дня официального опубликования приказа.
В проекте сказано, что МДС 81-35.2004 утратит силу со дня введения в действие новой Методики.
Данная методика состоит из 58 листов, но большая часть страниц данной Методики, а именно 35 листов – это только Термины и определения, Приложения и список литературы. Поэтому освоить этот документ не составит большого труда, тем более что нюансы, описанные в данной Методике, в основном повторяют положения МДС 81-35.2004, но с упором на ресурсный метод расчёта. Никакой речи о базисно-индексном методе расчёта нет, по причине того, что он не укладывается в направление выбранного Минстроем России курса на повышение достоверности определения сметной стоимости строительства.
Поэтому освоить этот документ не составит большого труда, тем более что нюансы, описанные в данной Методике, в основном повторяют положения МДС 81-35.2004, но с упором на ресурсный метод расчёта. Никакой речи о базисно-индексном методе расчёта нет, по причине того, что он не укладывается в направление выбранного Минстроем России курса на повышение достоверности определения сметной стоимости строительства.
На вопрос, откуда взять цены, нам ответит пункт 3.4.19 на странице 10(12) проекта новой Методики. Согласно данному пункту: «Сметная цена материального ресурса принимается на основании информации, размещенной во ФГИС». Далее в документе описан порядок определения стоимости ресурсов. Подробнее в п.3.4.21 проекта Методики.
СКАЧАТЬ — ПРОЕКТ «Методики определения стоимости строительной продукции на территории Российской Федерации»
Комментарий специалиста по данной методике Вы можете получить по тел. 217-17-37.
Отмена МДС 81-35.
 2004 08.10.2020
2004 08.10.2020Отмена МДС 81-35.2004
Приказ Минстроя России от 6 октября 2020 г. № 592/пр «О признании не подлежащими применению постановления Государственного комитета Российской Федерации по строительству и жилищно-коммунальному комплексу от 5 марта 2004 г. № 15/1, приказа Министерства регионального развития Российской Федерации от 1 июня 2012 г. № 220 и признании утратившим силу приказа Министерства строительства и жилищно-коммунального хозяйства Российской Федерации от 16 июня 2014 г. № 294/пр»
СКАЧАТЬ Приказ Минстроя России от 6 октября 2020 г. № 592/пр
Согласно Положения об организации и проведении государственной экспертизы проектной документации и результатов инженерных изысканий, утвержденного Постановлением Правительства Российской Федерации от 5 марта 2007 г. № 145 (с учетом изменений, внесенных Постановлением Правительства РФ от 31.
- Сметная стоимость, подлежащая проверке достоверности (проверке достоверности определения сметной стоимости строительства) в ходе государственной экспертизы проектной документации, начиная с 5 октября 2020 года должна быть определена с применением положений новой Методики определения сметной стоимости строительства (приказ Минстроя России от 04.08.2020 № 421/пр) если ее передача застройщику, заказчику (техническому заказчику) осуществляется, начиная с 5 октября 2020 года. При этом в организации по проведению государственной экспертизы должен представляться документ, подтверждающий передачу проектной документации (в том числе раздела «Смета») застройщику, заказчику (техническому заказчику).
- Сметная документация, переданная застройщику, заказчику (техническому заказчику) ранее 5 октября 2020 года и составленная с применением положений МДС 81-35.2004 (Методика определения стоимости строительной продукции на территории Российской Федерации) обязательной переработке в соответствии с новой Методикой (приказ 421/пр) не подлежит.

НОВАЯ МЕТОДИКА, утверждённая
23.09.2020 Минюст России зарегистрировал приказ Минстроя от 04.08.2020 N421/пр, об утверждении новой «Методики определения сметной стоимости строительства, реконструкции, капитального ремонта, сноса объектов капитального строительства, работ по сохранению объектов культурного наследия (памятников истории и культуры) народов Российской Федерации на территории Российской Федерации» (взамен МДС 81-35.2004).
СКАЧАТЬ Методику, утверждённую приказом Минстроя России от 04.08.2020 N421/пр
Отмена МДС 81-35.2004. Приказ Минстроя России от 6 октября 2020 г. № 592/пр
Приказ Минстроя России от 6 октября 2020 г. № 592/пр «О признании не подлежащими применению постановления Государственного комитета Российской Федерации по строительству и жилищно-коммунальному комплексу от 5 марта 2004 г. № 15/1, приказа Министерства регионального развития Российской Федерации от 1 июня 2012 г. № 220 и признании утратившим силу приказа Министерства строительства и жилищно-коммунального хозяйства Российской Федерации от 16 июня 2014 г. № 294/пр»
№ 15/1, приказа Министерства регионального развития Российской Федерации от 1 июня 2012 г. № 220 и признании утратившим силу приказа Министерства строительства и жилищно-коммунального хозяйства Российской Федерации от 16 июня 2014 г. № 294/пр»
СКАЧАТЬ Приказ Минстроя России от 6 октября 2020 г. № 592/пр
Согласно Положения об организации и проведении государственной экспертизы проектной документации и результатов инженерных изысканий, утвержденного Постановлением Правительства Российской Федерации от 5 марта 2007 г. № 145 (с учетом изменений, внесенных Постановлением Правительства РФ от 31.12.2019 г. № 1948 и Постановления Правительства РФ от 01.10.2020 № 1590):
- Сметная стоимость, подлежащая проверке достоверности (проверке достоверности определения сметной стоимости строительства) в ходе государственной экспертизы проектной документации, начиная с 5 октября 2020 года должна быть определена с применением положений новой Методики определения сметной стоимости строительства (приказ Минстроя России от 04.
 08.2020 № 421/пр) если ее передача застройщику, заказчику (техническому заказчику) осуществляется, начиная с 5 октября 2020 года. При этом в организации по проведению государственной экспертизы должен представляться документ, подтверждающий передачу проектной документации (в том числе раздела «Смета») застройщику, заказчику (техническому заказчику).
08.2020 № 421/пр) если ее передача застройщику, заказчику (техническому заказчику) осуществляется, начиная с 5 октября 2020 года. При этом в организации по проведению государственной экспертизы должен представляться документ, подтверждающий передачу проектной документации (в том числе раздела «Смета») застройщику, заказчику (техническому заказчику). - Сметная документация, переданная застройщику, заказчику (техническому заказчику) ранее 5 октября 2020 года и составленная с применением положений МДС 81-35.2004 (Методика определения стоимости строительной продукции на территории Российской Федерации) обязательной переработке в соответствии с новой Методикой (приказ 421/пр) не подлежит.
НОВАЯ МЕТОДИКА
23.09.2020 Минюст России зарегистрировал приказ Минстроя от 04.08.2020 N421/пр, об утверждении новой «Методики определения сметной стоимости строительства, реконструкции, капитального ремонта, сноса объектов капитального строительства, работ по сохранению объектов культурного наследия (памятников истории и культуры) народов Российской Федерации на территории Российской Федерации» (взамен МДС 81-35. 2004)
2004)
СКАЧАТЬ Методику взамен МДС 81-35.2004
Источник: www.smetarik.ru
Текущие проблемы и неудовлетворенные медицинские потребности в лечении миелодиспластических синдромов
Национальный институт рака. Просмотрите обзор статистики рака SEER за 1975-2016 гг. https://seer.cancer.gov/csr/1975_2016/browse_csr.php?sectionSEL=13&pageSEL=sect_13_table.16#table6. По состоянию на 22 марта 2021 г.
Американское онкологическое общество. Факторы риска миелодиспластических синдромов. https://www.cancer.org/cancer/myelodysplastic-syndrome/causes-risks-prevention/risk-factors.html. По состоянию на 22 марта 2021 г.
Национальный институт рака. Лечение миелодиспластических синдромов (PDQ®) – медицинская версия. https://www.cancer.gov/types/myeloproliferative/hp/myelodysplastic-treatment-pdq. По состоянию на 22 марта 2021 г.
Kuendgen A, Nomdedeu M, Tuechler H, Garcia-Manero G, Komrokji RS, Sekeres MA, et al. Связанные с терапией миелодиспластические синдромы заслуживают специальной диагностической подклассификации и стратификации риска — подхода к классификации пациентов с t-MDS.Лейкемия. 2021; 35: 835–49.
КАС пабмед Статья Google ученый
Bannon SA, DiNardo CD. Наследственная предрасположенность к миелодиспластическому синдрому. Int J Mol Sci. 2016;17:838.
Центральный пабмед Статья КАС пабмед Google ученый
Годли Л.А. Мутации зародышевой линии при предрасположенности к МДС/ОМЛ. Карр Опин Гематол. 2021; 28: 86–93.
КАС пабмед Статья Google ученый
Олива Э.Н., Финелли С., Сантини В., Полони А.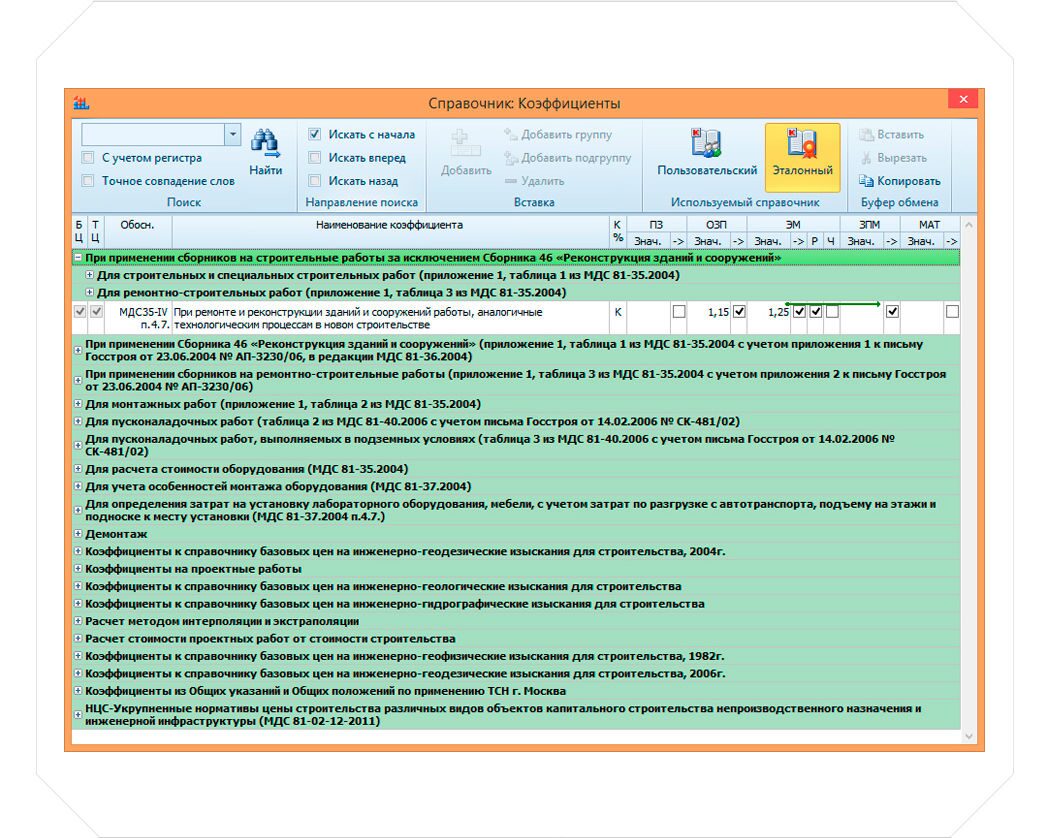 , Лисо В., Чиллони Д. и др. Качество жизни и восприятие врачей при миелодиспластических синдромах. Am J Blood Res. 2012;2:136–47.
, Лисо В., Чиллони Д. и др. Качество жизни и восприятие врачей при миелодиспластических синдромах. Am J Blood Res. 2012;2:136–47.
ПабМед ПабМед Центральный Google ученый
Секерес М.А., Мачеевский Дж.П., Лист А.Ф., Стенсма Д.П., Арц А., Сверн А.С. и др.Восприятие болезненного состояния, результатов лечения и прогноза среди пациентов с миелодиспластическими синдромами: результаты интернет-опроса. Онколог. 2011;16:904–11.
ПабМед ПабМед Центральный Статья Google ученый
Мальковати Л., Делла Порта М.Г., Каззола М. Прогнозирование выживаемости и развития лейкемии у пациентов с миелодиспластическим синдромом. Гематология. 2006; 91: 1588–90.
ПабМед Google ученый
Stensma DP, Heptinstall KV, Johnson VM, Novotny PJ, Sloan JA, Camoriano JK, et al.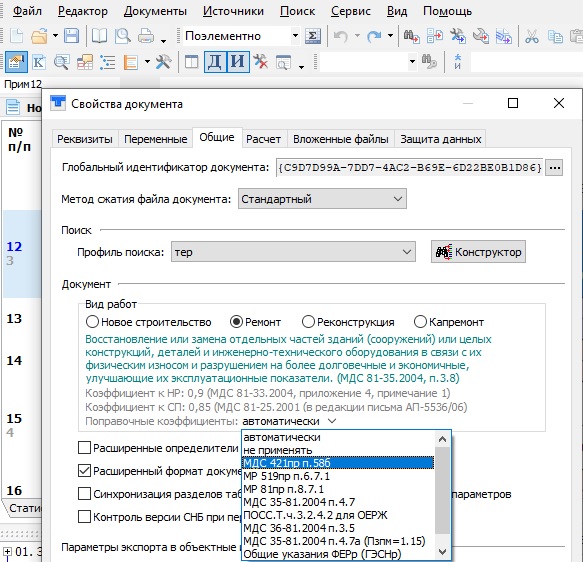 Общие неприятные симптомы и их влияние на качество жизни у пациентов с миелодиспластическими синдромами (МДС): результаты большого интернет-опроса. Лейк Рез. 2008; 32: 691–8.
Общие неприятные симптомы и их влияние на качество жизни у пациентов с миелодиспластическими синдромами (МДС): результаты большого интернет-опроса. Лейк Рез. 2008; 32: 691–8.
ПабМед Статья Google ученый
Jansen AJ, Essink-Bot ML, Beckers EA, Hop WC, Schipperus MR, Van, et al. Измерение качества жизни у пациентов с трансфузионно-зависимыми миелодиспластическими синдромами. Бр Дж Гематол. 2003; 121: 270–4.
КАС пабмед Статья Google ученый
Герминг Ю., Шредер Т., Кайверс Дж., Кундген А., Коббе Г., Гаттерманн Н.Новые методы лечения миелодиспластического синдрома низкого и высокого риска. Эксперт преподобный Гематол. 2019;12:893–908.
КАС пабмед Статья Google ученый
Форан Дж.М., Шаммо Дж.М. Клиника, диагностика и прогноз миелодиспластических синдромов. Am J Med. 2012;125:S6–13.
Am J Med. 2012;125:S6–13.
ПабМед Статья Google ученый
Морнет С., Галинат Х., Мингант Ф., Янотто Дж. К., Липперт Э.Тромбозы и тромбопатии при миелопролиферативных синдромах [Тромбоз и дисфункция тромбоцитов при миелопролиферативных новообразованиях]. Преподобный Мед Интерне. 2020;41:319–24.
КАС пабмед Статья Google ученый
Шанц Дж., Тухлер Х., Соле Ф., Малло М., Луно Э., Сервера Дж. и др. Новая комплексная система цитогенетической оценки первичных миелодиспластических синдромов (МДС) и олигобластного острого миелоидного лейкоза после МДС, полученная в результате слияния международной базы данных.Дж. Клин Онкол. 2012;30:820–9.
ПабМед ПабМед Центральный Статья Google ученый
Epstein-Peterson ZD, Spitzer B, McCarter J, McGovern E, Levine RL, Tallman MS De novo миелодиспластические синдромы у пациентов 20-50 лет, характеризующиеся частыми мутациями в TP53 и связанных с транскрипцией генах. Кровь. 2019;134:2708.
Кровь. 2019;134:2708.
Папаэммануил Э., Герстунг М., Мальковати Л., Тауро С., Гундем Г., Ван Лоо П. и др.Клинические и биологические последствия драйверных мутаций при миелодиспластических синдромах. Кровь. 2013; 122:3616–27.
КАС пабмед ПабМед Центральный Статья Google ученый
Гангат Н., Патнаик М.М., Теффери А. Миелодиспластические синдромы: современный обзор и методы лечения. Am J Гематол. 2016;91:76–89.
КАС пабмед Статья Google ученый
Национальная комплексная онкологическая сеть.Клинические рекомендации NCCN по онкологии (NCCN Guidelines®). Миелодиспластические синдромы. Версия 3. 2021.
Банасзак Л.Г., Рейниг Э., Лазарев М., Мэттисон Р.Дж. Реальное применение молекулярно-генетического секвенирования при лечении пациентов с острым миелоидным лейкозом и миелодиспластическими синдромами: опыт Висконсина. Кровь. 2019;134:2146.
Кровь. 2019;134:2146.
Ганстер С., Шааб Р., Ширнешан К., Эдер Л.Н., Мис А., Герминг У. и др. Статус TP53, а также цитогенетическая сложность существенно влияют на прогноз при миелодиспластических синдромах со сложными (≥3 аномалий) аберрантными кариотипами.Кровь. 2019;134:3007.
Bernard E, Nannya Y, Yoshizato T, Hasserjian RP, Saiki R, Shiozawa Y, et al. Состояние TP53 определяет стабильность генома, клиническую картину и исходы при миелодиспластических синдромах. Кровь. 2019;134:675.
Бехар Р., Стивенсон К., Абдель-Вахаб О., Галили Н., Нильссон Б., Гарсия-Манеро Г. и др. Клинический эффект точечных мутаций при миелодиспластических синдромах. N Engl J Med. 2011; 364:2496–506.
КАС пабмед ПабМед Центральный Статья Google ученый
Bernard E, Nannya Y, Hasserjian RP, Devlin SM, Tuechler H, Medina-Martinez JS, et al. Влияние аллельного состояния TP53 на стабильность генома, клиническую картину и исходы при миелодиспластических синдромах. Нат Мед. 2020; 26: 1549–56.
Влияние аллельного состояния TP53 на стабильность генома, клиническую картину и исходы при миелодиспластических синдромах. Нат Мед. 2020; 26: 1549–56.
КАС пабмед Статья Google ученый
Jiang L, Luo Y, Jin J, Tong H. Мутационный статус и бремя могут улучшить прогностическое прогнозирование пациентов с миелодиспластическими синдромами низкого риска. Кровь. 2019;134:3008.
Haferlach T, Nagata Y, Grossmann V, Okuno Y, Bacher U, Nagae G, et al.Ландшафт генетических поражений у 944 пациентов с миелодиспластическими синдромами. Лейкемия. 2014; 28: 241–7.
КАС пабмед Статья Google ученый
Хонг С., Керр С.М., Рыбицки Л., Висконте В., Дуррани Дж., Авада Х. и др. Паттерн соматических мутаций изменяется от диагноза до рецидива после аллогенной трансплантации гемопоэтических клеток (аллоГКТ) при остром миелоидном лейкозе (ОМЛ) и миелодиспластическом синдроме (МДС). Кровь.2019;134:2716.
Кровь.2019;134:2716.
Кеннеди Дж.А., Эберт Б.Л. Клинические последствия генетических мутаций при миелодиспластическом синдроме. Дж. Клин Онкол. 2017; 35: 968–74.
КАС пабмед ПабМед Центральный Статья Google ученый
Салман Д.А., Список А. Центральная роль воспалительной сигнализации в патогенезе миелодиспластических синдромов. Кровь. 2019; 133:1039–48.
КАС пабмед ПабМед Центральный Статья Google ученый
Гоце К.С., Платцбекер У.Старые псы, новые уловки: пересмотр иммуномодулирующих подходов к миелодиспластическим синдромам. Гемасфера. 2018;2:e162.
ПабМед ПабМед Центральный Статья Google ученый
Монтальбан-Браво Г., Гарсия-Манеро Г. Миелодиспластические синдромы: обновленная информация о диагностике, стратификации рисков и лечении за 2018 г. Am J Гематол. 2018;93:129–47.
Am J Гематол. 2018;93:129–47.
ПабМед Статья ПабМед Центральный Google ученый
Арбер Д.А., Орази А., Хассерджян Р., Тиле Дж., Боровиц М.Дж., Ле Бо М.М. и др.Пересмотренная в 2016 г. классификация миелоидных новообразований и острого лейкоза Всемирной организации здравоохранения. Кровь. 2016;127:2391–405.
КАС пабмед Статья ПабМед Центральный Google ученый
Гринберг П., Кокс С., ЛеБо М.М., Фено П., Морел П., Санс Г. и др. Международная система баллов для оценки прогноза при миелодиспластических синдромах. Кровь. 1997; 89: 2079–88.
КАС пабмед Статья ПабМед Центральный Google ученый
Malcovati L, Germing U, Kuendgen A, Della Porta MG, Pascutto C, Invernizzi R, et al.Зависимая от времени прогностическая система оценки для прогнозирования выживания и развития лейкемии при миелодиспластических синдромах. Дж. Клин Онкол. 2007; 25:3503–10.
Дж. Клин Онкол. 2007; 25:3503–10.
ПабМед Статья ПабМед Центральный Google ученый
Malcovati L, la Porta MG, Strupp C, Ambaglio I, Kuendgen A, Nachtkamp K, et al. Влияние степени анемии на исходы у пациентов с миелодиспластическим синдромом и ее интеграция в основанную на классификации ВОЗ систему прогностических оценок (WPSS).Гематология. 2011;96:1433–40.
КАС пабмед ПабМед Центральный Статья Google ученый
Greenberg PL, Tuechler H, Schanz J, Sanz G, Garcia-Manero G, Sole F, et al. Пересмотренная международная прогностическая система оценки миелодиспластических синдромов. Кровь. 2012;120:2454–65.
КАС пабмед ПабМед Центральный Статья Google ученый
Гарсия-Манеро Г., Шан Дж., Фадерл С., Кортес Дж. , Раванди Ф., Бортакур Г. и др.Прогностическая оценка для пациентов с миелодиспластическим синдромом низкого риска. Лейкемия. 2008; 22: 538–43.
, Раванди Ф., Бортакур Г. и др.Прогностическая оценка для пациентов с миелодиспластическим синдромом низкого риска. Лейкемия. 2008; 22: 538–43.
КАС пабмед Статья ПабМед Центральный Google ученый
Ван Б.А., Уэллс Р.А., Чодиркер Л., Роквуд К., Геддес М., Чжу Н. и др. Прогностическая эффективность показателей слабости у пациентов с МДС, получавших гипометилирующие агенты. Кровь. 2019;134:4245.
Benton CB, Khan M, Salman D, Nazha A, Nogueras Gonzalez GM, Piao J, et al.Прогноз пациентов с миелодиспластическим синдромом IPSS-R промежуточного риска указывает на различные результаты и потребность в моделях, выходящих за рамки IPSS-R. Am J Гематол. 2018;93:1245–53.
КАС пабмед ПабМед Центральный Статья Google ученый
Giagounidis A. Текущий алгоритм лечения МДС низкого риска. Программа Hematol Am Soc Hematol Educ. 2017; 2017: 453–9.
Программа Hematol Am Soc Hematol Educ. 2017; 2017: 453–9.
Артикул Google ученый
Платцбекер У.Лечение МДС. Кровь. 2019; 133:1096–107.
КАС пабмед Статья Google ученый
Стенсма ДП. Гемопоэтические факторы роста при миелодиспластических синдромах. Семин Онкол. 2011; 38: 635–47.
КАС пабмед Статья Google ученый
Fenaux P, Platzbecker U, Ades L. Как мы лечим взрослых с миелодиспластическим синдромом. Бр Дж Гематол.2020;189:1016–27.
КАС пабмед Статья Google ученый
Малковати Л., Хеллстром-Линдберг Э., Боуэн Д., Адес Л., Чермак Дж., Дель Канизо С. и др. Диагностика и лечение первичных миелодиспластических синдромов у взрослых: рекомендации European LeukemiaNet. Кровь. 2013; 122:2943–64.
Кровь. 2013; 122:2943–64.
КАС пабмед ПабМед Центральный Статья Google ученый
Стенсма ДП.Современный алгоритм лечения миелодиспластических синдромов 2018. Blood Cancer J. 2018;8:47.
ПабМед ПабМед Центральный Статья Google ученый
Гринберг П.Л., Сан З., Миллер К.Б., Беннет Дж.М., Таллман М.С., Девальд Г. и др. Лечение пациентов с миелодиспластическим синдромом эритропоэтином с гранулоцитарным колониестимулирующим фактором или без него: результаты проспективного рандомизированного исследования фазы 3, проведенного Восточной кооперативной онкологической группой (E1996).Кровь. 2009; 114: 2393–400.
КАС пабмед ПабМед Центральный Статья Google ученый
Комрокджи Р., Гарсия-Манеро Г., Адес Л., Пребет Т. , Стенсма Д.П., Юрчич Дж.Г. и др. Сотатерцепт с долгосрочным продлением для лечения анемии у пациентов с миелодиспластическими синдромами низкого риска: фаза 2, испытание с диапазоном доз. Ланцет Гематол. 2018;5:e63–72.
, Стенсма Д.П., Юрчич Дж.Г. и др. Сотатерцепт с долгосрочным продлением для лечения анемии у пациентов с миелодиспластическими синдромами низкого риска: фаза 2, испытание с диапазоном доз. Ланцет Гематол. 2018;5:e63–72.
ПабМед Статья Google ученый
Фено П., Платцбекер У., Муфтий Г.Дж., Гарсия-Манеро Г., Бакштейн Р., Сантини В. и др.Луспатерцепт у пациентов с миелодиспластическими синдромами низкого риска. N Engl J Med. 2020; 382: 140–51.
КАС пабмед Статья Google ученый
Fenaux P., Kiladjian JJ, Platzbecker U. Люспатерцепт для лечения анемии при миелодиспластических синдромах и первичном миелофиброзе. Кровь. 2019;133:790–4.
КАС пабмед Статья Google ученый
Platzbecker U, Germing U, Götze KS, Kiewe P, Mayer K, Chromik J, et al. Луспатерцепт для лечения анемии у пациентов с миелодиспластическими синдромами низкого риска (PACE-MDS): многоцентровое открытое исследование фазы 2 по подбору дозы с долгосрочным дополнительным исследованием. Ланцет Онкол. 2017;18:1338–47.
Луспатерцепт для лечения анемии у пациентов с миелодиспластическими синдромами низкого риска (PACE-MDS): многоцентровое открытое исследование фазы 2 по подбору дозы с долгосрочным дополнительным исследованием. Ланцет Онкол. 2017;18:1338–47.
КАС пабмед Статья Google ученый
Европейское агентство по лекарственным средствам. Reblozyl 2020. https://www.ema.europa.eu/en/medicines/human/EPAR/reblozyl#authorisation-details-section. По состоянию на 22 марта 2021 г.
VIDAZA® (азацитидин для инъекций), для подкожного или внутривенного введения [вкладыш в упаковке]. Саммит, Нью-Джерси: Celgene Corporation; 2018.
DACOGEN® (децитабин) для инъекций, для внутривенного введения [вкладыш]. Харлем, Нидерланды: Pharmachemie BV Haarlem; 2018.
Европейское агентство по лекарственным средствам. Dacogen 2019. https://www.ema.europa.eu/en/medicines/human/EPAR/dacogen#authorisation-details-section. По состоянию на 22 марта 2021 г.
https://www.ema.europa.eu/en/medicines/human/EPAR/dacogen#authorisation-details-section. По состоянию на 22 марта 2021 г.
Ван Х., Ли И, Лв Н, Ли И, Ван Л, Ю Л.Предикторы клинического ответа на гипометилирующие агенты при остром миелоидном лейкозе или миелодиспластическом синдроме. Энн Хематол. 2018;97:2025–38.
ПабМед Статья Google ученый
Stahl M, DeVeaux M, de Witte T, Neukirchen J, Sekeres MA, Brunner AM, et al. Использование иммуносупрессивной терапии при МДС: клинические исходы и их предикторы в большой международной когорте пациентов. Кровь Adv. 2018;2:1765–72.
КАС пабмед ПабМед Центральный Статья Google ученый
Европейское агентство по лекарственным средствам.Revlimid 2020. https://www.ema.europa.eu/en/medicines/human/EPAR/revlimid#product-information-section. По состоянию на 22 марта 2021 г.
По состоянию на 22 марта 2021 г.
РЕВЛИМИД® (леналидомид) капсулы [вкладыш]. Саммит, Нью-Джерси: Celgene Corporation; 2019.
Lode L, Menard A, Flet L, Richebourg S, Loirat M, Eveillard M, et al. Возникновение и эволюция мутаций TP53 являются ключевыми признаками прогрессирования заболевания у пациентов с миелодисплазией с del(5q) низкого риска, получавших лечение леналидомидом.Гематология. 2018;103:e143–6.
Сантини В., Алмейда А., Гиагунидис А., Гроппер С., Йонасова А., Вей Н. и другие. Рандомизированное исследование фазы III леналидомида по сравнению с плацебо у пациентов, зависимых от переливания эритроцитов, с миелодиспластическими синдромами низкого риска, не относящимися к del(5q), и неподходящими или рефрактерными к препаратам, стимулирующим эритропоэз. Дж. Клин Онкол. 2016;34:2988–96.
КАС пабмед Статья Google ученый
де Витте Т., Боуэн Д., Робин М., Малковати Л., Нидервизер Д., Якуб-Ага И. и др.Аллогенная трансплантация гемопоэтических стволовых клеток при МДС и ХММЛ: рекомендации международной группы экспертов. Кровь. 2017; 129:1753–62.
ПабМед ПабМед Центральный Статья КАС Google ученый
Schuler E, Zadrozny N, Blum S, Schroeder T, Strupp C, Hildebrandt B, et al. Долгосрочные исходы у пациентов высокого риска с миелодиспластическими синдромами или вторичным острым миелоидным лейкозом, получающих интенсивную химиотерапию.Энн Хематол. 2018;97:2325–32.
ПабМед Статья Google ученый
Scheid C, de Wreede L, van Biezen A, Koenecke C, Gohring G, Volin L, et al. Валидация пересмотренного IPSS при трансплантации у пациентов с миелодиспластическим синдромом / трансформированным острым миелогенным лейкозом, получающих аллогенную трансплантацию стволовых клеток: ретроспективный анализ рабочей группы EBMT по хроническим злокачественным новообразованиям. Трансплант костного мозга. 2017;52:1519–25.
Трансплант костного мозга. 2017;52:1519–25.
КАС Статья Google ученый
Соррор М.Л., Сторб Р.Ф., Сандмайер Б.М., Мазиарз Р.Т., Пульсифер М.А., Марис М.Б. и др. Индекс коморбидности и возраста: клиническая мера биологического возраста до аллогенной трансплантации гемопоэтических клеток. Дж. Клин Онкол. 2014; 32:3249–56.
ПабМед ПабМед Центральный Статья Google ученый
Соррор М.Л., Марис М.Б., Сторб Р., Барон Ф., Сандмайер Б.М., Малони Д.Г. и др.Индекс коморбидности, специфичный для трансплантации гемопоэтических клеток (HCT): новый инструмент для оценки риска перед аллогенной HCT. Кровь. 2005; 106: 2912–9.
КАС пабмед ПабМед Центральный Статья Google ученый
Grunwald MR, Zhang MJ, Elmariah H, Johnson MH, St. Martin A, Bashey A, et al. Аллогенная трансплантация при миелодиспластическом синдроме у взрослых старше 50 лет с использованием сниженной интенсивности/немиелоаблативного кондиционирования: гаплоидентичный родственник по сравнению с неродственным донором.Кровь. 2019;134:3323.
Martin A, Bashey A, et al. Аллогенная трансплантация при миелодиспластическом синдроме у взрослых старше 50 лет с использованием сниженной интенсивности/немиелоаблативного кондиционирования: гаплоидентичный родственник по сравнению с неродственным донором.Кровь. 2019;134:3323.
Робертс Л., Салит Р.Б., Лонго Л., Сюэ Э., Саммерс С., Делани С. и др. Трансплантация пуповинной крови является эффективным методом лечения пациентов с миелодиспластическим и миелопролиферативным синдромами. Кровь. 2019;134:2048.
Wang W, Auer P, Spellman SR, Carlson KSB, Nazha A, Maiers M, et al. Эпигеномные сигнатуры у пациентов с миелодиспластическим синдромом как предикторы совместимости доноров и результатов трансплантации. Кровь. 2019;134:4557.
Катлер С.С., Ли С.Дж., Гринберг П., Диг Х.Дж., Перес В.С., Анасетти С. и др. Анализ принятия решения об аллогенной трансплантации костного мозга при миелодиспластических синдромах: отсроченная трансплантация при миелодисплазии низкого риска связана с улучшением исхода. Кровь. 2004; 104: 579–85.
Кровь. 2004; 104: 579–85.
КАС пабмед Статья Google ученый
Schroeder T, Wegener N, Lauseker M, Rautenberg C, Nachtkamp K, Schuler E, et al.Сравнение предварительной трансплантации и различных подходов к предтрансплантационному циторедуктивному лечению у пациентов с миелодиспластическим синдромом высокого риска и вторичным острым миелогенным лейкозом. Biol Blood Marrow Transpl. 2019;25:1550–9.
Артикул Google ученый
Stein EM, Latremouille-Viau D, Joseph GJ, Shi S, Guerin A, Wu EQ, et al. Модели лечения и исходы у пациентов с миелодиспластическими синдромами, получавших гипометилирующие агенты: анализ SEER-Medicare.Кровь. 2019;134:3495.
Берналь Т., Мартинес-Камблор П., Санчес-Гарсия Дж., де Пас Р., Луно Э., Номдедеу Б. и др. Эффективность азацитидина при невыбранных миелодиспластических синдромах высокого риска: результаты испанского регистра. Лейкемия. 2015; 29:1875–81.
Лейкемия. 2015; 29:1875–81.
КАС пабмед Статья ПабМед Центральный Google ученый
Itzykson R, Thepot S, Quesnel B, Dreyfus F, Beyne-Rauzy O, Turlure P, et al.Прогностические факторы ответа и общей выживаемости у 282 пациентов с миелодиспластическими синдромами высокого риска, получавших азацитидин. Кровь. 2011;117:403–11.
КАС пабмед Статья ПабМед Центральный Google ученый
Craddock CF, Houlton AE, Quek LS, Ferguson P, Gbandi E, Roberts C, et al. Исход терапии азацитидином при остром миелоидном лейкозе не улучшается при одновременной терапии вориностатом, но прогнозируется диагностической молекулярной сигнатурой.Клин Рак Рез. 2017;23:6430–40.
КАС пабмед Статья ПабМед Центральный Google ученый
Бехар Р. , Лорд А., Стивенсон К., Бар-Натан М., Перес-Ладага А., Заневельд Дж. и др. Мутации TET2 предсказывают реакцию на гипометилирующие агенты у пациентов с миелодиспластическим синдромом. Кровь. 2014; 124:2705–12.
, Лорд А., Стивенсон К., Бар-Натан М., Перес-Ладага А., Заневельд Дж. и др. Мутации TET2 предсказывают реакцию на гипометилирующие агенты у пациентов с миелодиспластическим синдромом. Кровь. 2014; 124:2705–12.
КАС пабмед ПабМед Центральный Статья Google ученый
Браун Т., Ициксон Р., Ренневиль А., де Ренцис Б., Дрейфус Ф., Лариби К. и др.Молекулярные предикторы ответа на децитабин при прогрессирующем хроническом миеломоноцитарном лейкозе: исследование фазы 2. Кровь. 2011; 118:3824–31.
КАС пабмед Статья ПабМед Центральный Google ученый
Henry DH, Glaspy J, Harrup RA, Mittelman M, Zhou A, Carraway HE, et al. Пероральный роксадустат продемонстрировал эффективность при анемии, вторичной по отношению к миелодиспластическому синдрому низкого риска, независимо от кольцевых сидеробластов и исходных уровней эритропоэтина. Кровь. 2020;136:1277.
Кровь. 2020;136:1277.
Стенсма Д.П., Фено П., Ван Эйген К., Раза А., Сантини В., Герминг У. и др. Иметелстат обеспечивает значимую и длительную независимость от переливания крови у пациентов с высокой нагрузкой на переливание крови с миелодиспластическими синдромами низкого риска в исследовании фазы II. Дж. Клин Онкол. 2021; 39: 48–56.
ПабМед Статья ПабМед Центральный Google ученый
Олива Э.Н., Алати С., Сантини В., Полони А., Молтени А., Нискола П. и др.Элтромбопаг по сравнению с плацебо при миелодиспластических синдромах низкого риска с тромбоцитопенией (EQoL-MDS): результаты фазы 1 одинарного слепого рандомизированного контролируемого исследования превосходства фазы 2. Ланцет Гематол. 2017;4:e127–36.
ПабМед Статья ПабМед Центральный Google ученый
Platzbecker U, Sekeres MA, Kantarjian H, Giagounidis A, Mufti GJ, Jia C, et al. Взаимосвязь различных критериев ответа тромбоцитов и результатов лечения пациентов в исследовании миелодиспластических синдромов ромиплостима.Лейкемия. 2014;28:2418–21.
Взаимосвязь различных критериев ответа тромбоцитов и результатов лечения пациентов в исследовании миелодиспластических синдромов ромиплостима.Лейкемия. 2014;28:2418–21.
КАС пабмед ПабМед Центральный Статья Google ученый
Миттельман М., Платцбекер Ю., Афанасьев Б., Гросицки С., Вонг Р.С.М., Анагностопулос А. и др. Элтромбопаг при запущенных миелодиспластических синдромах или остром миелоидном лейкозе и тяжелой тромбоцитопении (ASPIRE): рандомизированное плацебо-контролируемое исследование 2 фазы. Ланцет Гематол. 2018;5:e34–43.
ПабМед Статья Google ученый
Fenaux P, Muus P, Kantarjian H, Lyons RM, Larson RA, Sekeres MA, et al.Монотерапия ромиплостимом у пациентов с тромбоцитопенией и миелодиспластическими синдромами: долгосрочная безопасность и эффективность. Бр Дж Гематол. 2017; 178:906–13.
КАС пабмед ПабМед Центральный Статья Google ученый
Гарсия-Манеро Г., Сантини В., Алмейда А., Платцбекер У., Йонасова А., Сильверман Л. и др. Плацебо-контролируемое исследование фазы III CC-486 у пациентов с зависимой от переливания эритроцитов (RBC-TD) анемией и тромбоцитопенией из-за миелодиспластических синдромов низкого риска IPSS (LR-MDS).Представлено на: 25-м ежегодном конгрессе Европейской гематологической ассоциации; 11–21 июня 2020 г.; Виртуальный.
Эксиоглу Э.А., Чен Х, Хайдер К.Х., Рютер Б., МакГроу К.Л., Басиорка А.А. и соавт. Новый терапевтический подход к улучшению кроветворения при МДС с низким риском путем нацеливания на MDSC с помощью Fc-инженерного антитела к CD33 BI 836858. Лейкемия. 2017;31:2172–80.
КАС пабмед ПабМед Центральный Статья Google ученый
Smith V, Eckard S, Rettig MP, Gehrs LN, Gueno J, Wei S, et al.AMV564, двухвалентный, биспецифический активатор Т-клеток, истощает супрессорные клетки миелоидного происхождения и активирует Т-клетки у онкологических больных. Представлено на ежегодном собрании Американской ассоциации исследований рака; 27–28 апреля 2020 г. и 22–24 июня 2020 г.; Филадельфия, Пенсильвания. Abstract 5699.
Представлено на ежегодном собрании Американской ассоциации исследований рака; 27–28 апреля 2020 г. и 22–24 июня 2020 г.; Филадельфия, Пенсильвания. Abstract 5699.
Sebert M, Renneville A, Bally C, Peterlin P, Beyne-Rauzy O, Legros L, et al. Исследование фазы II гуадецитабина при миелодиспластическом синдроме высокого риска и остром миелоидном лейкозе с низким количеством бластов после неудачи азацитидина.Гематология 2019;104:1565–71.
КАС пабмед ПабМед Центральный Статья Google ученый
Savona MR, McCloskey JK, Griffiths EA, Yee KWL, Al-Kali A, Zeidan AM, et al. Клиническая эффективность и безопасность перорального приема децитабина/цедазуридина у 133 пациентов с миелодиспластическими синдромами (МДС) и хроническим миеломоноцитарным лейкозом (ХММЛ). Кровь. 2020;136:1230.
Секерес М.А., Уоттс Дж.М., Радинов А., Сангерман М. А., Серрано М., Лопес П.Ф. и др.Эффективность и безопасность певонедистата в сочетании с азацитидином по сравнению с монотерапией азацитидином при миелодиспластических синдромах высокого риска (МДС) по данным исследования P-2001 (NCT02610777). Кровь. 2020;136:653.
А., Серрано М., Лопес П.Ф. и др.Эффективность и безопасность певонедистата в сочетании с азацитидином по сравнению с монотерапией азацитидином при миелодиспластических синдромах высокого риска (МДС) по данным исследования P-2001 (NCT02610777). Кровь. 2020;136:653.
Richard-Carpentier G, DeZern AE, Takahashi K, Konopleva MY, Loghavi S, Masarova L, et al. Предварительные результаты исследования фазы II ингибитора IDh3 энасидениба у пациентов с миелодиспластическим синдромом (МДС) с мутацией IDh3 высокого риска. Кровь. 2019;134:678.
Foran JM, DiNardo CD, Watts JM, Stein EM, De Botton S, Fathi AT, et al.Ивозидениб (AG-120) у пациентов с рецидивирующим/рефрактерным миелодиспластическим синдромом с мутацией IDh2: обновленный набор в фазу 1 исследования повышения и расширения дозы. Кровь. 2019;134:4254.
Cortes JE, Wang ES, Watts JM, Lee S, Baer MR, Dao KH, et al. Олутазидениб (FT-2102) вызывает быструю ремиссию у пациентов с IDh2-мутантным миелодиспластическим синдромом: результаты лечения монопрепаратом фазы 1/2 и комбинации с азацитидином.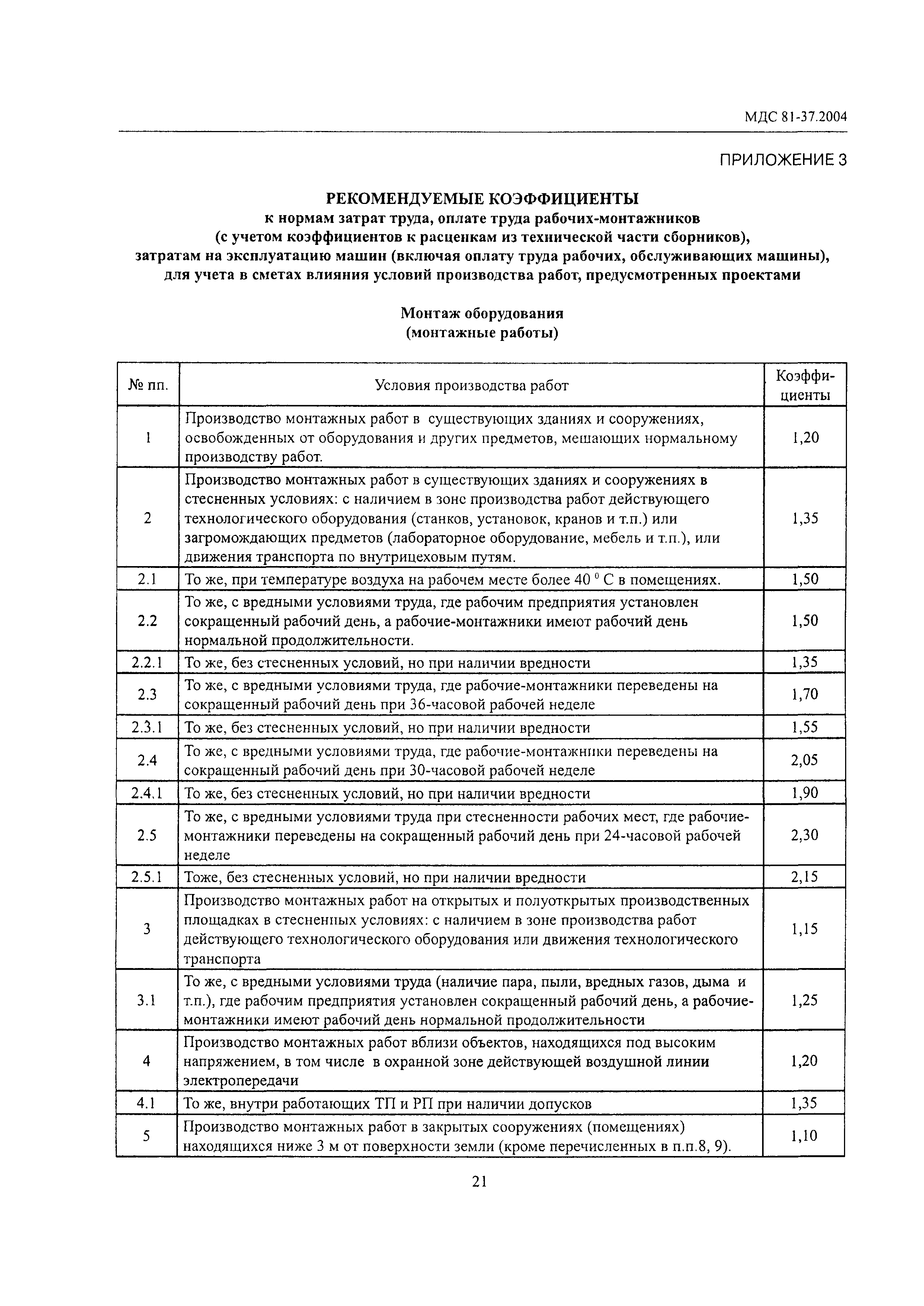 Кровь. 2019;134:674.
Кровь. 2019;134:674.
Zeidan AM, Pollyea DA, Garcia JS, Brunner A, Roncolato F, Borate U, et al.Исследование фазы 1b по оценке безопасности и эффективности венетоклакса в качестве монотерапии или в комбинации с азацитидином для лечения рецидивирующего/рефрактерного миелодиспластического синдрома. Кровь. 2019;134:565.
Гердс А.Т., Скотт Б.Л., Гринберг П.Л., Халед С.К., Лин Т.Л., Полли Д.А. и др. Блокада PD-L1 атезолизумабом при миелодиспластическом синдроме высокого риска: первоначальный анализ безопасности и эффективности. Кровь. 2018;132:466.
Гарсия-Манеро Г., Сасаки К., Монтальбан-Браво Г., Давер Н.Г., Джаббур Э.Дж., Альварадо И. и др.Исследование II фазы ниволумаба или ипилимумаба с азацитидином или без него у пациентов с миелодиспластическим синдромом (МДС). Кровь. 2018;132:465.
Бруннер А.М., Эстев Дж., Поркка К., Кнаппер С., Вей Н. , Шолл С. и др. Эффективность и безопасность сабатолимаба (MBG453) в сочетании с гипометилирующими агентами (HMA) у пациентов с острым миелоидным лейкозом (ОМЛ) и миелодиспластическим синдромом высокого риска (HR-MDS): обновленные результаты исследования фазы 1b. Кровь. 2020;136:657.
, Шолл С. и др. Эффективность и безопасность сабатолимаба (MBG453) в сочетании с гипометилирующими агентами (HMA) у пациентов с острым миелоидным лейкозом (ОМЛ) и миелодиспластическим синдромом высокого риска (HR-MDS): обновленные результаты исследования фазы 1b. Кровь. 2020;136:657.
Navada SC, Garcia-Manero G, Atallah EL, Rajeh MN, Shammo JM, Griffiths EA, et al.Исследование II фазы перорального применения ригосертиба в сочетании с азацитидином (АЗА) в качестве терапии первой линии у пациентов (Pts) с миелодиспластическими синдромами высокого риска (HR-MDS). Кровь. 2019;134:566.
Garcia-Manero G, Navada SC, Fenaux P, Zbyszewski PS, Adesanya AR, Azarnia N, et al. Фаза 3, многоцентровое, международное, рандомизированное, двойное слепое, плацебо-контролируемое исследование перорального применения ригосертиба + инъекционного азацитидина (АЗА) по сравнению с инъекционным азацитидином у ранее не получавших лечения пациентов с миелодиспластическим синдромом высокого риска (HR-MDS)..jpg) Кровь. 2019;134:4268.
Кровь. 2019;134:4268.
Stein EM, Fathi AT, DiNardo CD, Pollyea DA, Roboz GJ, Collins R, et al. Эназидениб у пациентов с миелодиспластическими синдромами с мутацией IDh3: анализ подгрупп фазы 1 многоцентрового исследования AG221-C-001. Ланцет Гематол. 2020; 7: e309–19.
ПабМед Статья Google ученый
Cortes JE, Douglas Smith B, Wang ES, Merchant A, Oehler VG, Arellano M, et al. Глаздегиб в комбинации с цитарабином и даунорубицином у пациентов с ОМЛ или МДС высокого риска: результаты исследования 2 фазы.Am J Гематол. 2018;93:1301–10.
КАС пабмед ПабМед Центральный Статья Google ученый
Wei AH, Garcia JS, Borate U, Fong CY, Baer MR, Nolte F, et al. Исследование фазы 1b по оценке безопасности и эффективности венетоклакса в комбинации с азацитидином у ранее не получавших лечения пациентов с миелодиспластическим синдромом высокого риска. Кровь. 2019;134:568.
Кровь. 2019;134:568.
Липосомы VYXEOS® (даунорубицин и цитарабин) для инъекций, для внутривенного введения [вкладыш в упаковку].Пало-Альто, Калифорния: Jazz Pharmaceuticals, Inc.; 2021.
Lin TL, Uy GL, Wieduwilt MJ, Newell LF, Stuart RK, Medeiros BC, et al. Субанализ пациентов с вторичным острым миелоидным лейкозом (sAML) с рефрактерной анемией с избытком трансформирующихся бластов (RAEB-t), включенных в исследование фазы 3 CPX-351 по сравнению с обычными 7+3 цитарабином и даунорубицином. Кровь. 2017;130:1698.
Garcia-Manero G, Fenaux P, Al-Kali A, Baer MR, Sekeres MA, Roboz GJ, et al.Ригосертиб в сравнении с лучшей поддерживающей терапией у пациентов с миелодиспластическими синдромами высокого риска после неэффективности гипометилирующих препаратов (ONTIME): рандомизированное контролируемое исследование фазы 3. Ланцет Онкол. 2016; 17: 496–508.
КАС пабмед Статья Google ученый
Терапия Онконова. Онконова Терапия объявляет об основных результатах ключевого исследования INSPIRE фазы 3. 2020. https://www.globenewswire.com/news-release/2020/08/24/2082504/0/en/Onconova-Therapeutics-Announces-Topline-Results-from-the-Pivotal-Phase-3-INSPIRE- Пробный.HTML. По состоянию на 22 марта 2021 г.
Gil-Perez A, Montalban-Bravo G. Лечение миелодиспластических синдромов после отсутствия ответа на гипометилирующие агенты. Тер Ад Гематол. 2019;10:2040620719847059.
КАС пабмед ПабМед Центральный Статья Google ученый
Дейвер Н., Страти П., Джаббур Э., Кадия Т., Лутра Р., Ван С. и др. Мутации FLT3 при миелодиспластическом синдроме и хроническом миеломоноцитарном лейкозе.Am J Гематол. 2013;88:56–9.
Ши Л.И., Хуан С.Ф., Ван П.Н., Ву Д.Х., Лин Т.Л., Данн П. и др. Приобретение мутаций FLT3 или N-ras часто связано с прогрессированием миелодиспластического синдрома в острый миелоидный лейкоз. Лейкемия. 2004; 18: 466–75.
Лейкемия. 2004; 18: 466–75.
КАС пабмед Статья Google ученый
Стенсма Д.П., Вермке М., Климек В.М., Гринберг П.Л., Фонт П., Комрокджи Р.С. и др. Результаты клинического испытания модулятора сплайсинга h4B-8800 у пациентов с миелодиспластическими синдромами (МДС), острым миелоидным лейкозом (ОМЛ) или хроническим миеломоноцитарным лейкозом (ХММЛ).Кровь. 2019;134:673.
Uy GL, Godwin J, Rettig MP, et al. Предварительные результаты исследования фазы 1 флотетузумаба, биспецифического белка Dart® CD123 x CD3, у пациентов с рецидивирующим/рефрактерным острым миелоидным лейкозом и миелодиспластическим синдромом. Кровь. 2017;130:637.
Кубаш А.С., Петерлин П., Клузо Т., Гетце К.С., Сокель К., Тейпель Р. и др. Эффективность и безопасность бемцентиниба у пациентов с миелодиспластическими синдромами или острым миелоидным лейкозом, которым не помогают гипометилирующие препараты. Кровь. 2020;136:1287.
Кровь. 2020;136:1287.
Салман Д.А., ДеЗерн А.Е., Гарсия-Манеро Г., Стенсма Д.П., Робоз Г.Дж., Секерес М.А. и др. Эпренетапопт (APR-246) и азацитидин при миелодиспластических синдромах с мутацией TP53. Дж. Клин Онкол. 2021; 39: 1584–94.
Aprea Therapeutics. Aprea Therapeutics объявляет о результатах первичной конечной точки исследования фазы 3 эпренетапопта при миелодиспластическом синдроме (МДС) с мутацией TP53. 2020 г. https://ir.aprea.com/news-releases/news-release-details/aprea-therapy-announces-results-primary-endpoint-phase-3.По состоянию на 22 марта 2021 г.
Карвахал Л.А., Нерия Д.Б., Сенекал А., Бенард Л., Тирутуванатан В., Яценко Т. и др. Двойное ингибирование MDMX и MDM2 как терапевтическая стратегия при лейкемии. Sci Transl Med. 2018;10:eaao3003.
ПабМед ПабМед Центральный Статья КАС Google ученый
Салман Д.А., Аш А.С., Аль Малки М.М., Ли Д.Дж., Доннеллан В.Б., Маркуччи Г. и др. Первое в своем классе анти-CD47 антитело магролимаб (5F9) в комбинации с азацитидином эффективно у пациентов с МДС и ОМЛ: текущие результаты фазы 1b.Кровь. 2019;134:569.
Ричи Э.К., Миа С.К., Ли С., Курсио Т., Десаи П., Болл Дж. и др. CPX-351 в качестве первой интенсивной терапии для пожилых пациентов с ОМЛ. Кровь. 2019;134:3858.
DiNardo CD, Pratz K, Pullarkat V, Jonas BA, Arellano M, Becker PS, et al. Венетоклакс в сочетании с децитабином или азацитидином у ранее не получавших лечения пожилых пациентов с острым миелоидным лейкозом. Кровь. 2019; 133:7–17.
КАС пабмед ПабМед Центральный Статья Google ученый
Cluzeau T, Sebert M, Rahmé R, Cuzzubbo S, Walter-petrich A, Lehmann che J, et al.APR-246 в сочетании с азацитидином (AZA) при миелодиспластическом синдроме (МДС) с мутацией TP53 и остром миелоидном лейкозе (ОМЛ). Исследование фазы 2, проведенное группой Francophone Des Myélodysplasies (GFM). Кровь. 2019;134:677.
Исследование фазы 2, проведенное группой Francophone Des Myélodysplasies (GFM). Кровь. 2019;134:677.
Schroeder T, Rachlis E, Bug G, Stelljes M, Klein S, Steckel NK, et al. Лечение острого миелоидного лейкоза или рецидива миелодиспластического синдрома после аллогенной трансплантации стволовых клеток с помощью инфузий азацитидина и донорских лимфоцитов — ретроспективный многоцентровый анализ Немецкой кооперативной исследовательской группы по трансплантации.Biol Blood Marrow Transpl. 2015;21:653–60.
КАС Статья Google ученый
Шапиро Р.М., Ким ДДХ. Мониторинг минимальной остаточной болезни на основе секвенирования следующего поколения у пациентов, получающих аллогенную трансплантацию гемопоэтических стволовых клеток по поводу острого миелоидного лейкоза или миелодиспластического синдрома. Карр Опин Гематол. 2018;25:425–32.
ПабМед Статья Google ученый
Ролофф Г.В., Лай С., Хуриган К.С., Диллон Л.В.Технические достижения в измерении остаточной болезни при остром миелоидном лейкозе. Дж. Клин Мед. 2017;6:87.
Центральный пабмед Статья КАС пабмед Google ученый
Раутенберг С., Пехтель С., Хильдебрандт Б., Бетц Б., Динст А., Нахткамп К. и др. Экспрессия гена опухоли Вильмса 1 с использованием стандартизированного европейского анализа, сертифицированного LeukemiaNet, по сравнению с другими методами обнаружения минимальной остаточной болезни при миелодиспластическом синдроме и остром миелогенном лейкозе после аллогенной трансплантации стволовых клеток крови.Biol Blood Marrow Transpl. 2018;24:2337–43.
КАС Статья Google ученый
Platzbecker U, Middeke JM, Sockel K, Herbst R, Wolf D, Baldus CD, et al. Измеримое лечение азацитидином, управляемое остаточной болезнью, для предотвращения гематологического рецидива у пациентов с миелодиспластическим синдромом и острым миелоидным лейкозом (RELAZA2): открытое многоцентровое исследование фазы 2. Ланцет Онкол. 2018;19:1668–79.
Ланцет Онкол. 2018;19:1668–79.
КАС пабмед Статья Google ученый
Pfeilstocker M, Tuechler H, Sanz G, Schanz J, Garcia-Manero G, Sole F, et al.Зависимые от времени изменения смертности и риска трансформации при МДС. Кровь. 2016; 128:902–10.
ПабМед ПабМед Центральный Статья КАС Google ученый
Линдсли RC. Расшифровка генетической гетерогенности миелодиспластического синдрома. Программа Hematol Am Soc Hematol Educ. 2017; 2017: 447–52.
Артикул Google ученый
Первичная миелодисплазия у взрослых в возрасте до 50 лет: клинико-патологическое исследование 52 пациентов
Bennett JM, Catovsky D, Daniel MT, Flandrin G, Galton DAG, Gralnick HR, Sultan C .Предложения по классификации миелодиспластических синдромов Br J Haematol 1982 51 : 189–199
CAS Статья Google ученый
Фукар К. , Лэнгдон Р.М.И., Армитаж Д.О., Олсон Д.Б., Кэрролл Т.Дж.Дж. Миелодиспластические синдромы. Клинический и патологоанатомический анализ 109 случаев Рак 1985 56 : 553–561
, Лэнгдон Р.М.И., Армитаж Д.О., Олсон Д.Б., Кэрролл Т.Дж.Дж. Миелодиспластические синдромы. Клинический и патологоанатомический анализ 109 случаев Рак 1985 56 : 553–561
CAS Статья Google ученый
ЛеБо М., Албен К., Ларсон Р., Вардиман Дж., Дэвис Э., Блау Р., Голомб Х., Роули Дж. .Клинические и цитогенетические корреляции у 63 пациентов с связанными с терапией миелодиспластическими синдромами и острым нелимфоцитарным лейкозом: дополнительные доказательства характерных аномалий хромосом 5 и 7 Статья Google ученый
Кантарджян Х.М., Китинг М.Дж. Связанный с терапией лейкоз и миелодиспластический синдром Semin Oncol 1987 14 : 435–443
CAS пабмед Google ученый
Педерсен-Бьергор Дж .Связанная с терапией миелодисплазия и острый лейкоз Лейк-лимфома 1995 15 : 11–12
Статья Google ученый
Traweek ST, Slovak ML, Nademanee AP, Brynes RK, Niland JC, Forman SJ . Миелодисплазия и острый миелоидный лейкоз после аутологичной трансплантации костного мозга по поводу лимфомы Leuk Lymphoma 1996 20 : 365–372
Миелодисплазия и острый миелоидный лейкоз после аутологичной трансплантации костного мозга по поводу лимфомы Leuk Lymphoma 1996 20 : 365–372
CAS Статья Google ученый
Якуб-Ага И., ДеЛаСальмоньер П., Рибо П., Саттон Л., Ваттель Э., Кюнц М., Жуэ Дж., Марит Г., Мильпье Н., Деконинк Э., Гратекос Н., Лепорье М., Чаббер И., Кайо Д., Дамадж Г. , Дориак С, Дрейфус Ф, Франсуа С, Молина Л, Танги М, Шевре С, Глюкман Э .Аллогенная трансплантация костного мозга при связанном с терапией миелодиспластическом синдроме и остром миелоидном лейкозе: долгосрочное исследование 70 пациентов – отчет Французского общества трансплантации костного мозга J Clin Oncol 2000 18 : 963–971
CAS Статья Google ученый
Гигер М., Бонни Ю., Форест Л. . Синдром детской моносомии 7 Am J Hematol 1982 13 : 329–334
CAS Статья Google ученый
Пассмор С. Дж., Ханн И.М., Стиллер К.А., Рамани П., Суонсбери Г.Дж., Гиббонс Б., Ривз Б.Р., Чесселс Д.М.Детская миелодисплазия: исследование 68 детей и новая прогностическая система оценки Кровь 1995 85 : 1742–1750
Дж., Ханн И.М., Стиллер К.А., Рамани П., Суонсбери Г.Дж., Гиббонс Б., Ривз Б.Р., Чесселс Д.М.Детская миелодисплазия: исследование 68 детей и новая прогностическая система оценки Кровь 1995 85 : 1742–1750
CAS пабмед ПабМед Центральный Google ученый
Бадер-Менье Б., Мило Ф., Черня Г., Бюзин Дж., Делсол Г., Дюшен Э., Лемерль С., Леверже Г., деЛумли Л., Манель А.М., Натансон М., Плантаз Д., Роберт А., Шайсон Г., Соммелет Д. , Вилмер Э. Миелодиспластические синдромы у детей: отчет 49 пациентов из французского многоцентрового исследования Br J Haematol 1996 92 : 344–350
CAS Статья Google ученый
Пассмор С.Дж., Ханн И.М.Детская миелодисплазия Br Med Bull 1996 52 : 778–786
CAS Статья Google ученый
Кройциг Ю. , Риттер Дж., Формур Дж., Людвиг В.Д., Нимейер К., Райниш И., Столлманн-Гиббельс Б., Циммерманн М., Харботт Дж. . Миелодисплазия и острый миелогенный лейкоз при синдроме Дауна Лейкемия 1996 10 : 1677–1686
, Риттер Дж., Формур Дж., Людвиг В.Д., Нимейер К., Райниш И., Столлманн-Гиббельс Б., Циммерманн М., Харботт Дж. . Миелодисплазия и острый миелогенный лейкоз при синдроме Дауна Лейкемия 1996 10 : 1677–1686
CAS пабмед ПабМед Центральный Google ученый
Барнард Д., Калоусек Д., Вирсма С., Ланге Б., Бенджамин Д., Артур Д., Бакли Дж., Кобрински Н., Нойдорф С., Сандерс Дж., Миллер Л., ДеСварт Дж., Шина Д., Хаммонд Г., Вудс В. .Морфологическая, иммунологическая и цитогенетическая классификация острого миелоидного лейкоза и миелодиспластического синдрома у детей: отчет Детской онкологической группы Лейкемия 1996 10 : 5–12
CAS Google ученый
Дэвис С.М., Вагнер Дж.Э., Дефор Т., Блазар Б.Р., Катсанис Э., Керси Дж.Х., Орчард П.Дж., Макглэйв П.Б., Вайсдорф Д.Дж., Рамзи Н.К. Трансплантация костного мозга от неродственного донора детям и подросткам с апластической анемией или миелодисплазией Br J Haematol 1997 96 : 749–756
CAS Статья Google ученый
Французская группа цитогенетической гематологии. Сорок четыре случая детской миелодисплазии с цитогенетикой, задокументированные Французской цитогенетической гематологической группой Лейкемия 1997 11 : 1478–1485
Сорок четыре случая детской миелодисплазии с цитогенетикой, задокументированные Французской цитогенетической гематологической группой Лейкемия 1997 11 : 1478–1485
, Жуэ Ж, Баутерс Ф. De novo миелодиспластические синдромы у взрослых в возрасте 50 лет и младше. Отчет о 37 случаях Leuk Res 1990 14 : 1053–1059
CAS Статья Google ученый
Керкхофс Х., Хагемейер А., Леексма Ч.В., Абельс Дж., ДенОттоландер Г.Дж., Сомерс Р., Герритс В.Б.Дж., Лангенхуйен MMAC, фон дем Борн АЭГК, ван Хемель Дж.О., Гераэдтс Дж.П.М.Аномалия 5q-хромосомы при гематологических заболеваниях: совместное исследование 34 случаев из Нидерландов Br J Haematol 1982 52 : 365–381
CAS Статья Google ученый
Groupe Francaise De Morphologie Hematologique. Французский регистр острых лейкозов и миелодиспластических синдромов. Распределение по возрасту и анализ гемограмм 4496 случаев, зарегистрированных в 1982–1983 гг. и классифицированных в соответствии с критериями FAB Каллат М.П., Аккар Ф., Шаперон Дж.Прогностические факторы миелодиспластических синдромов – упрощенная трехмерная система оценки Leuk Res 1990 14 : 255–262
Французский регистр острых лейкозов и миелодиспластических синдромов. Распределение по возрасту и анализ гемограмм 4496 случаев, зарегистрированных в 1982–1983 гг. и классифицированных в соответствии с критериями FAB Каллат М.П., Аккар Ф., Шаперон Дж.Прогностические факторы миелодиспластических синдромов – упрощенная трехмерная система оценки Leuk Res 1990 14 : 255–262
CAS Статья Google ученый
Аул С., Гаттерман Н., Хейлл А., Герминг У., Деригс Г., Шнайдер В. . Первичные миелодиспластические синдромы: анализ прогностических факторов у 235 пациентов и предложения по усовершенствованной системе оценки пабмед ПабМед Центральный Google ученый
Мэтью П., Теффери А., Девальд Г.В., Голдберг С.Л., Су Дж., Хоугланд Х.К., Ноэль П. .Синдром 5q–: одноцентровое исследование 43 последовательных пациентов Кровь 1993 81 : 1040–1045
CAS Google ученый
Саттон Л. , Частанг С., Рибо П., Жуэ Дж. П., Кюнц М., Аттал М., Райфферс Дж., Тиго Дж. М., Рио Б., Дауриак С., Легрос М., Дрейфус Ф., Лиур Б., Труссар Х., Мильпье Н., Витц Ф., Ориол П., Кан Дж. Ю., Мишалле М., Глюкман Э., Ифра Н., Пико Дж. Л., Вилмер Э., Леблон В. . Факторы, влияющие на исход de novo миелодиспластических синдромов, леченных аллогенной трансплантацией костного мозга: долгосрочное исследование 71 пациента
пабмед
Google ученый
, Частанг С., Рибо П., Жуэ Дж. П., Кюнц М., Аттал М., Райфферс Дж., Тиго Дж. М., Рио Б., Дауриак С., Легрос М., Дрейфус Ф., Лиур Б., Труссар Х., Мильпье Н., Витц Ф., Ориол П., Кан Дж. Ю., Мишалле М., Глюкман Э., Ифра Н., Пико Дж. Л., Вилмер Э., Леблон В. . Факторы, влияющие на исход de novo миелодиспластических синдромов, леченных аллогенной трансплантацией костного мозга: долгосрочное исследование 71 пациента
пабмед
Google ученый
Соле Ф., Эспинет Б., Санс Г.Ф., Сервера Х., Каласанз М.Дж., Луно Э., Прието Ф., Гранада I, Эрнандес Х.М., Сигудоса Х.К., Диез Х.Л., Бюро Э., Маркес М.Л., Арранс Э., Риос Р., Мартинес -Климент Дж.А., Валлеспи Т., Флоренса Л., Весснер С.Частота, характеристика и прогностическое значение хромосомных аномалий у 640 пациентов с первичными миелодиспластическими синдромами. Grupo Cooperativo Espanol de Citogenetica Hematologica Br J Haematol 2000 108 : 346–356
CAS Статья Google ученый
Муфтий Г. Дж., Стивенс Дж. Р., Осьер Д. Г., Хэмблин Т. Дж., Мачин Д. . Миелодиспластические синдромы: система подсчета баллов, имеющая прогностическое значение
Статья
Google ученый
Дж., Стивенс Дж. Р., Осьер Д. Г., Хэмблин Т. Дж., Мачин Д. . Миелодиспластические синдромы: система подсчета баллов, имеющая прогностическое значение
Статья
Google ученый
Уорсли А., Осьер Д.Г., Стивенс Дж., Дарлоу С., Фигес А., Муфтий Г.Дж., Хэмблин Т.Дж.Прогностические признаки хронического миеломоноцитарного лейкоза: модифицированная Борнмутская шкала дает наилучший прогноз выживаемости Статья Google ученый
Санс Г.Ф., Санс М.А., Валлеспи Т., Канизо М.С., Торрабаделла М., Гарсия С., Ирригибл Д., Сан-Мигель Х.Ф. Две регрессионные модели и балльная система для прогнозирования выживаемости и планирования лечения при миелодиспластических синдромах: многофакторный анализ прогностических факторов у 370 пациентов пабмед ПабМед Центральный Google ученый
Морель П. , Хеббар М., Лай Ж-Л., Дюамель А., Прюдомм С., Ваттель Э., Баутерс Ф., Фено П. .Цитогенетический анализ имеет сильное независимое прогностическое значение при de novo миелодиспластических синдромах и может быть включен в новую систему оценки: отчет о 408 случаях
Google ученый
, Хеббар М., Лай Ж-Л., Дюамель А., Прюдомм С., Ваттель Э., Баутерс Ф., Фено П. .Цитогенетический анализ имеет сильное независимое прогностическое значение при de novo миелодиспластических синдромах и может быть включен в новую систему оценки: отчет о 408 случаях
Google ученый
Гринберг П., Кокс С., ЛеБо М.М., Фено П., Морель П., Санс Г., Санс М., Валлеспи Т., Хамблин Т., Осьер Д., Охяшики К., Тояма К., Аул С., Муфтий Г., Беннетт Дж. Международная система баллов для оценки прогноза при миелодиспластических синдромах Кровь 1997 89 : 2079–2088
CAS Google ученый
Нанд С., Годвин Дж. Э. .Гипопластический миелодиспластический синдром Рак 1988 62 : 958–964
CAS Статья Google ученый
Тузунер Н., Кокс С. , Роу Дж., Уотроус Д., Беннет Дж. . Гипоцеллюлярные миелодиспластические синдромы (МДС): новые предложения Br J Haematol 1995 91 : 612–617
, Роу Дж., Уотроус Д., Беннет Дж. . Гипоцеллюлярные миелодиспластические синдромы (МДС): новые предложения Br J Haematol 1995 91 : 612–617
CAS Статья Google ученый
Мительман Ф (ред.). ISCN (1995): Международная система цитогенетической номенклатуры человека Karger: Basel 1995
Google ученый
Брюннинг Р . Предложенная Всемирной организацией здравоохранения (ВОЗ) классификация острых лейкозов и миелодиспластических синдромов Mod Pathol 1999 12 : 102
Google ученый
Кархер Д., Фрост А. . Костный мозг при заболевании, связанном с вирусом иммунодефицита человека (ВИЧ).Морфология и клиническая корреляция Am J Clin Pathol 1991 95 : 63–71
CAS Статья Google ученый
Уоттс Э. , Майер Р., Грин П., Мавор В. . Гиперфибротическая миелодисплазия: отчет о трех случаях гематологической ремиссии после лечения преднизолоном
Статья
Google ученый
, Майер Р., Грин П., Мавор В. . Гиперфибротическая миелодисплазия: отчет о трех случаях гематологической ремиссии после лечения преднизолоном
Статья
Google ученый
Манги М., Муфтий Г. .Первичные миелодиспластические синдромы: диагностическое и прогностическое значение иммуногистохимической оценки биоптатов костного мозга Кровь 1992 79 : 198–205
CAS пабмед Google ученый
Клэтч Р., Кригман Х., Петерс М., Цуттер М. . Диспластический гемопоэз после ортотопической трансплантации печени: сравнение с аналогичными изменениями при ВИЧ-инфекции и первичной миелодисплазии Статья Google ученый
Калуци В., Кольмейер Ю., Машек Х., Нафе Р., Хориц Х., Амор А., Георгий А. .Сравнение костного мозга и гематологических данных у пациентов с инфекцией, вызванной вирусом иммунодефицита человека, и пациентов с миелодиспластическими синдромами и инфекционными заболеваниями Статья Google ученый
Хэмблин Т. Дж. Иммунологические нарушения при миелодиспластических синдромах Semin Hematol 1996 33 : 150–162
Дж. Иммунологические нарушения при миелодиспластических синдромах Semin Hematol 1996 33 : 150–162
CAS пабмед Google ученый
Фено П., Морель П., Лай Дж.Цитогенетика миелодиспластических синдромов Семин Гематол 1996 33 : 127–138
CAS Google ученый
Браннинг Р.Д., МакКенна Р.В. Опухоли костного мозга В: Rosai J (ред.) Атлас патологии опухолей Институт патологии вооруженных сил: Bethesda 1994 стр. 161
Google ученый
Yunis JJ, Brunning RD . Прогностическое значение хромосомных аномалий при острых лейкозах и миелодиспластических синдромах Clin Hematol 1986 15 : 597–620
CAS Google ученый
Болтвуд Дж. , Фидлер К. .Хромосомные делеции при миелодисплазии Лейк-лимфома 1995 17 : 71–78
, Фидлер К. .Хромосомные делеции при миелодисплазии Лейк-лимфома 1995 17 : 71–78
CAS Статья Google ученый
Арбер Д.А., Чанг К.Л., Спилбергер Р.Т., Словак М.Л. t(3;5) миелодисплазия высокой степени и острый миелоидный лейкоз у молодых взрослых положительно реагирует на аллогенную трансплантацию костного мозга Leuk Res 1997 21 : S52
Статья Google ученый
Григг А., Гаскойн Р., Филлипс Г., Хорсман Д. .Клинические, гематологические и цитогенетические особенности у 24 пациентов со структурными перестройками плеча Q хромосомы 3 Br J Haematol 1993 83 : 158–165
CAS Статья Google ученый
Эскудье С., Альбитар М., Робертсон Л., Андреефф М., Пирс С., Кантарджян Х . Острый лимфобластный лейкоз после предлейкемических синдромов у взрослых Лейкемия 1996 10 : 473–477
CAS пабмед Google ученый
Lima CS, deSouza CA, Cardinalli IA, Lorand-Metze I . Лимфобластная трансформация миелодиспластического синдрома Rev Paul Med 1997 115 : 1508–1512
Лимфобластная трансформация миелодиспластического синдрома Rev Paul Med 1997 115 : 1508–1512
CAS Google ученый
Balduini CL, Guarnone R, Pecci A, Centenara E, Invernizzi R, Ascari E . Миелодиспластические синдромы: прогностическая ценность восьми прогностических систем в 143 случаях из одного учреждения пабмед Google ученый
Continuous ‘Service Exited в системном журнале
У меня та же проблема, вход в систему занимает минуту после выхода из спящего режима, единственное, что я смог найти, это это
Жирным шрифтом указано время, которое кажется зависшим при входе в систему.
Начало входа в систему с 17:13:22
7 июня 17:13:22 **** syslogd[100]: Статистика отправителя ASL
7 июня 17:13:26 **** com.apple.xpc. launchd[1] (com.apple.mdworker.shared.01000000-0300-0000-0000-000000000000[11773]): выход из службы из-за SIGKILL | отправлено mds[127]
7 июня 17:13:30 **** timed[141]: settimeofday({0x5edd041a,0x2a165}) == 0
7 июня 17:13:30 **** xpcproxy[ 11782]: libcoreservices: _dirhelper_userdir: 557: bootstrap_look_up вернул (ipc/send) недопустимый порт назначения
7 июня 17:13:31 **** com. apple.xpc.launchd[1] (com.apple.mdworker.shared.0B000000-0600-0000-0000-000000000000[11772]): выход из службы из-за SIGKILL | отправлено mds[127]
apple.xpc.launchd[1] (com.apple.mdworker.shared.0B000000-0600-0000-0000-000000000000[11772]): выход из службы из-за SIGKILL | отправлено mds[127]
7 июня 17:13:38 **** timed[141]: settimeofday({0x5edd0422,0xbc147}) == 0
7 июня 17:13:39 **** syncdefaultsd[ 11793].Один из двух будет использован. Какой из них не определено.
7 июня 17:13:39 **** syncdefaultsd[11793]: objc[11793]: класс SYDJournal реализован как в /System/Library/PrivateFrameworks/SyncedDefaults.framework/Versions/A/SyncedDefaults, так и в /System /Library/PrivateFrameworks/SyncedDefaults.framework/Support/syncdefaultsd. Один из двух будет использован. Какой из них не определено.
7 июня 17:15:19 **** com.apple.xpc.launchd[1] (com.apple.mdworker.shared.05000000-0700-0000-0000-000000000000[11771]): выход из службы из-за SIGKILL | отправлено mds[127]
7 июня 17:15:27 **** com.apple.xpc.launchd[1] (com.apple.mdworker.shared.01000000-0400-0000-0000-000000000000[11783] ): служба закрыта из-за SIGKILL | отправлено mds[127]
7 июня 17:15:27 **** com. apple.xpc.launchd[1] (com.apple.mdworker.shared.0B000000-0100-0000-0000-000000000000[11789] ): служба закрыта из-за SIGKILL | отправлено mds[127]
apple.xpc.launchd[1] (com.apple.mdworker.shared.0B000000-0100-0000-0000-000000000000[11789] ): служба закрыта из-за SIGKILL | отправлено mds[127]
7 июн 17:15:27 **** com.apple.xpc.launchd[1] (com.apple.mdworker.shared.0E000000-0000-0000-0000-000000000000[11769]): выход из службы из-за SIGKILL | отправлено mds[127]
7 июня 17:15:29 **** Diagnosticd[7813]: разрешение доступа консоли (11796) к потоку из-за статуса администратора
7 июня 17:15:29 **** Diagnosticd [7813]: фильтр потока сообщений: «{global = 47245099008;}»
7 июня 17:15:31 **** диагностика [7813]: запущен клиент системного режима — консоль (11796) — режим: 0xb, фильтр: «<пусто>»
7 июня 17:15:58 **** AMPDeviceDiscoveryAgent[407]: Entered:_AMMuxedDeviceDisconnected, mux-device:937
7 июня 17:15:58 **** AMPDeviceDiscoveryAgent[407]: Введено:__thr_AMMuxedDeviceDisconnected, mux-device:937
7 июня 17:15:58 **** AMPDeviceDiscoveryAgent[407]: tid:6b33 — Идентификатор мультиплексора не найден в словаре сопоставлений
7 июня 17:15:58 *** * AMPDeviceDiscoveryAgent[407]: tid:6b33 — Не удается обработать отключение с недопустимым ecid
7 июня 17:16:03 **** com. apple.xpc.launchd[1] (com.apple.mdworker.shared.05000000-0000-0000-0000-000000000000[11803]): выход из службы из-за SIGKILL | отправлено mds[127]
apple.xpc.launchd[1] (com.apple.mdworker.shared.05000000-0000-0000-0000-000000000000[11803]): выход из службы из-за SIGKILL | отправлено mds[127]
7 июня 17:16:07 **** com.apple.xpc.launchd[1] (com.apple.xpc.launchd.domain.pid.backupd.11798): не удалось загрузить path: path = /System/Library/CoreServices/backupd.bundle/Contents/Resources/backupd, error = 2: Нет такого файла или каталога
Обувь Nike Vapor 13 Academy Mds TF • магазин uk.takemore.net
Nike Vapor 13 Академия Mds TFCJ1306110Найк
//i10.takemore.net//uk.takemore.net/nike/vapor-13-academy-mds-tf-cj1306110£49,00ПредзаказНовое состояние//uk.takemore.net/nike/vapor-13-academy-mds-tf-cj1306110/ /i10.takemore.net
НазадО бренде Nike
Американская компания
Nike является одним из крупнейших производителей спортивной обуви, одежды и аксессуаров. Она была основана в 1972 году в округе Вашингтон (штат Орегон). Название компании происходит от имени Ники — греческой богини победы. Бренд предлагает такую обувь, как футбольная. С самого начала существования компания спонсировала многих ведущих спортсменов и спортивные команды по всему миру, снабжая их одеждой и обувью, например, круглый год.
Бренд предлагает такую обувь, как футбольная. С самого начала существования компания спонсировала многих ведущих спортсменов и спортивные команды по всему миру, снабжая их одеждой и обувью, например, круглый год.Описание Nike Vapor 13 Academy Mds TF
Футбольные бутсы Nike Vapor 13 Academy Mds TF CJ1306-110 обеспечивают отличный контакт с мячом и точность удара на каждом поле. Подошва Nike обеспечивает оптимальное сцепление, что выражается в ускорении во всех направлениях и невероятной маневренности футболиста на игровом поле.Конструкция верха делает обувь очень легкой и удобной в использовании, и в то же время обеспечивает свободную вентиляцию (влага быстро и эффективно выводится наружу). Nike, используя новейшие технические решения в своей футбольной обуви, значительно улучшает тактические способности игрока. Данная модель предназначена для игры в сезон: . Футбольные бутсы Nike Vapor 13 Academy Mds TF for обеспечивают отличное ускорение, маневренность и высочайшее качество изготовления. Эта модель должна удовлетворить даже придирчивых игроков.
Эта модель должна удовлетворить даже придирчивых игроков.Системы Nike Vapor 13 Academy Mds TF
Особенности Nike Vapor 13 Academy Mds TF
Марка: Найк
Категория: обувь
Цвет: Белый, Серый, Черный
Единственный: Тлумач-Терфи
Резать: получешки
Цель: Футбол
${Описание}
— ${Имя}
Gale Apps — Технические трудности
Технические трудности
Приложение, к которому вы пытаетесь получить доступ, в настоящее время недоступно.Приносим свои извинения за доставленные неудобства. Повторите попытку через несколько секунд.
Если проблемы с доступом сохраняются, обратитесь за помощью в наш отдел технической поддержки по телефону 1-800-877-4253. Еще раз спасибо, что выбрали Gale, обучающую компанию Cengage.
org. springframework.remoting.RemoteAccessException: невозможно получить доступ к удаленной службе [authorizationService@theBLISAuthorizationService]; вложенным исключением является Ice.Неизвестное исключение
unknown = «java.lang.IndexOutOfBoundsException: индекс 0 выходит за границы для длины 0
в java.base/jdk.internal.util.Preconditions.outOfBounds(Preconditions.java:64)
в java.base/jdk.internal.util.Preconditions.outOfBoundsCheckIndex(Preconditions.java:70)
в java.base/jdk.internal.util.Preconditions.checkIndex(Preconditions.java:248)
в java.base/java.util.Objects.checkIndex(Objects.java:372)
на Яве.база/java.util.ArrayList.get(ArrayList.java:458)
в com.gale.blis.data.subscription.dao.LazyUserSessionDataLoaderStoredProcedure.populateSessionProperties(LazyUserSessionDataLoaderStoredProcedure.java:60)
в com.gale.blis.data.subscription.dao.LazyUserSessionDataLoaderStoredProcedure.reQuery(LazyUserSessionDataLoaderStoredProcedure.
springframework.remoting.RemoteAccessException: невозможно получить доступ к удаленной службе [authorizationService@theBLISAuthorizationService]; вложенным исключением является Ice.Неизвестное исключение
unknown = «java.lang.IndexOutOfBoundsException: индекс 0 выходит за границы для длины 0
в java.base/jdk.internal.util.Preconditions.outOfBounds(Preconditions.java:64)
в java.base/jdk.internal.util.Preconditions.outOfBoundsCheckIndex(Preconditions.java:70)
в java.base/jdk.internal.util.Preconditions.checkIndex(Preconditions.java:248)
в java.base/java.util.Objects.checkIndex(Objects.java:372)
на Яве.база/java.util.ArrayList.get(ArrayList.java:458)
в com.gale.blis.data.subscription.dao.LazyUserSessionDataLoaderStoredProcedure.populateSessionProperties(LazyUserSessionDataLoaderStoredProcedure.java:60)
в com.gale.blis.data.subscription.dao.LazyUserSessionDataLoaderStoredProcedure.reQuery(LazyUserSessionDataLoaderStoredProcedure. java:53)
в com.gale.blis.data.model.session.UserGroupEntitlementsManager.reinitializeUserGroupEntitlements(UserGroupEntitlementsManager.ява:30)
в com.gale.blis.data.model.session.UserGroupSessionManager.getUserGroupEntitlements(UserGroupSessionManager.java:17)
в com.gale.blis.api.authorize.contentmodulefetchers.CrossSearchProductContentModuleFetcher.getProductSubscriptionCriteria(CrossSearchProductContentModuleFetcher.java:244)
на com.gale.blis.api.authorize.contentmodulefetchers.CrossSearchProductContentModuleFetcher.getSubscribedCrossSearchProductsForUser(CrossSearchProductContentModuleFetcher.ява:71)
на com.gale.blis.api.authorize.contentmodulefetchers.CrossSearchProductContentModuleFetcher.getAvailableContentModulesForProduct(CrossSearchProductContentModuleFetcher.java:52)
на com.gale.blis.api.authorize.strategy.productentry.strategy.AbstractProductEntryAuthorizer.getContentModules(AbstractProductEntryAuthorizer.
java:53)
в com.gale.blis.data.model.session.UserGroupEntitlementsManager.reinitializeUserGroupEntitlements(UserGroupEntitlementsManager.ява:30)
в com.gale.blis.data.model.session.UserGroupSessionManager.getUserGroupEntitlements(UserGroupSessionManager.java:17)
в com.gale.blis.api.authorize.contentmodulefetchers.CrossSearchProductContentModuleFetcher.getProductSubscriptionCriteria(CrossSearchProductContentModuleFetcher.java:244)
на com.gale.blis.api.authorize.contentmodulefetchers.CrossSearchProductContentModuleFetcher.getSubscribedCrossSearchProductsForUser(CrossSearchProductContentModuleFetcher.ява:71)
на com.gale.blis.api.authorize.contentmodulefetchers.CrossSearchProductContentModuleFetcher.getAvailableContentModulesForProduct(CrossSearchProductContentModuleFetcher.java:52)
на com.gale.blis.api.authorize.strategy.productentry.strategy.AbstractProductEntryAuthorizer.getContentModules(AbstractProductEntryAuthorizer. java:130)
на com.gale.blis.api.authorize.strategy.productentry.strategy.CrossSearchProductEntryAuthorizer.isAuthorized(CrossSearchProductEntryAuthorizer.ява:82)
на com.gale.blis.api.authorize.strategy.productentry.strategy.CrossSearchProductEntryAuthorizer.authorizeProductEntry(CrossSearchProductEntryAuthorizer.java:44)
на com.gale.blis.api.authorize.strategy.ProductEntryAuthorizer.authorize(ProductEntryAuthorizer.java:31)
в com.gale.blis.api.BLISAuthorizationServiceImpl.authorize_aroundBody0(BLISAuthorizationServiceImpl.java:57)
на com.gale.blis.api.BLISAuthorizationServiceImpl.authorize_aroundBody1$advice(BLISAuthorizationServiceImpl.ява: 61)
на com.gale.blis.api.BLISAuthorizationServiceImpl.authorize(BLISAuthorizationServiceImpl.java:1)
на com.gale.blis.auth._AuthorizationServiceDisp._iceD_authorize(_AuthorizationServiceDisp.java:141)
в com.gale.blis.auth._AuthorizationServiceDisp.
java:130)
на com.gale.blis.api.authorize.strategy.productentry.strategy.CrossSearchProductEntryAuthorizer.isAuthorized(CrossSearchProductEntryAuthorizer.ява:82)
на com.gale.blis.api.authorize.strategy.productentry.strategy.CrossSearchProductEntryAuthorizer.authorizeProductEntry(CrossSearchProductEntryAuthorizer.java:44)
на com.gale.blis.api.authorize.strategy.ProductEntryAuthorizer.authorize(ProductEntryAuthorizer.java:31)
в com.gale.blis.api.BLISAuthorizationServiceImpl.authorize_aroundBody0(BLISAuthorizationServiceImpl.java:57)
на com.gale.blis.api.BLISAuthorizationServiceImpl.authorize_aroundBody1$advice(BLISAuthorizationServiceImpl.ява: 61)
на com.gale.blis.api.BLISAuthorizationServiceImpl.authorize(BLISAuthorizationServiceImpl.java:1)
на com.gale.blis.auth._AuthorizationServiceDisp._iceD_authorize(_AuthorizationServiceDisp.java:141)
в com.gale.blis.auth._AuthorizationServiceDisp. _iceDispatch(_AuthorizationServiceDisp.java:359)
в IceInternal.Incoming.invoke(Incoming.java:209)
в Ice.ConnectionI.invokeAll(ConnectionI.java:2800)
на льду.ConnectionI.dispatch(ConnectionI.java:1385)
в Ice.ConnectionI.message(ConnectionI.java:1296)
в IceInternal.ThreadPool.run(ThreadPool.java:396)
в IceInternal.ThreadPool.access$500(ThreadPool.java:7)
в IceInternal.ThreadPool$EventHandlerThread.run(ThreadPool.java:765)
в java.base/java.lang.Thread.run(Thread.java:834)
»
org.springframework.remoting.ice.IceClientInterceptor.convertIceAccessException(IceClientInterceptor.java:365) org.springframework.remoting.ice.IceClientInterceptor.invoke(IceClientInterceptor.java:327) org.springframework.remoting.ice.MonitoringIceProxyFactoryBean.invoke(MonitoringIceProxyFactoryBean.java:71) org.springframework.aop.framework.ReflectiveMethodInvocation.
_iceDispatch(_AuthorizationServiceDisp.java:359)
в IceInternal.Incoming.invoke(Incoming.java:209)
в Ice.ConnectionI.invokeAll(ConnectionI.java:2800)
на льду.ConnectionI.dispatch(ConnectionI.java:1385)
в Ice.ConnectionI.message(ConnectionI.java:1296)
в IceInternal.ThreadPool.run(ThreadPool.java:396)
в IceInternal.ThreadPool.access$500(ThreadPool.java:7)
в IceInternal.ThreadPool$EventHandlerThread.run(ThreadPool.java:765)
в java.base/java.lang.Thread.run(Thread.java:834)
»
org.springframework.remoting.ice.IceClientInterceptor.convertIceAccessException(IceClientInterceptor.java:365) org.springframework.remoting.ice.IceClientInterceptor.invoke(IceClientInterceptor.java:327) org.springframework.remoting.ice.MonitoringIceProxyFactoryBean.invoke(MonitoringIceProxyFactoryBean.java:71) org.springframework.aop.framework.ReflectiveMethodInvocation.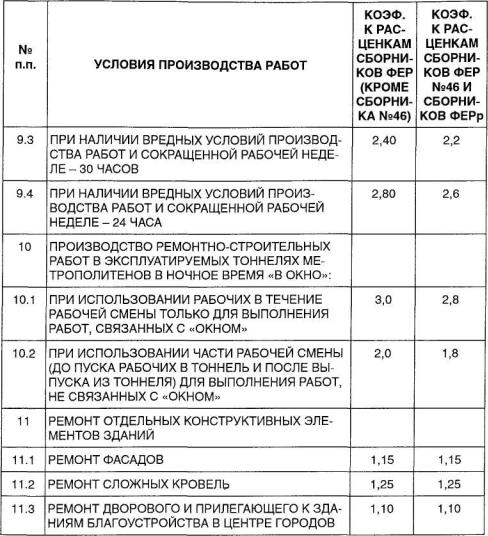 proceed(ReflectiveMethodInvocation.java:186) org.springframework.aop.framework.JdkDynamicAopProxy.invoke(JdkDynamicAopProxy.java:212) com.sun.proxy.$Proxy130.authorize(Неизвестный источник) com.gale.auth.service.BlisService.getAuthorizationResponse(BlisService.java:61) com.gale.apps.service.impl.MetadataResolverService.resolveMetadata(MetadataResolverService.java:65) com.gale.apps.controllers.DiscoveryController.resolveDocument(DiscoveryController.java:57) ком.gale.apps.controllers.DocumentController.redirectToDocument(DocumentController.java:22) jdk.internal.reflect.GeneratedMethodAccessor252.invoke (неизвестный источник) java.base/jdk.internal.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43) java.base/java.lang.reflect.Method.invoke(Method.java:566) org.springframework.web.method.support.InvocableHandlerMethod.doInvoke(InvocableHandlerMethod.ява: 215) org.springframework.web.method.support.InvocableHandlerMethod.invokeForRequest(InvocableHandlerMethod.
proceed(ReflectiveMethodInvocation.java:186) org.springframework.aop.framework.JdkDynamicAopProxy.invoke(JdkDynamicAopProxy.java:212) com.sun.proxy.$Proxy130.authorize(Неизвестный источник) com.gale.auth.service.BlisService.getAuthorizationResponse(BlisService.java:61) com.gale.apps.service.impl.MetadataResolverService.resolveMetadata(MetadataResolverService.java:65) com.gale.apps.controllers.DiscoveryController.resolveDocument(DiscoveryController.java:57) ком.gale.apps.controllers.DocumentController.redirectToDocument(DocumentController.java:22) jdk.internal.reflect.GeneratedMethodAccessor252.invoke (неизвестный источник) java.base/jdk.internal.reflect.DelegatingMethodAccessorImpl.invoke(DelegatingMethodAccessorImpl.java:43) java.base/java.lang.reflect.Method.invoke(Method.java:566) org.springframework.web.method.support.InvocableHandlerMethod.doInvoke(InvocableHandlerMethod.ява: 215) org.springframework.web.method.support.InvocableHandlerMethod.invokeForRequest(InvocableHandlerMethod. java:142) org.springframework.web.servlet.mvc.method.annotation.ServletInvocableHandlerMethod.invokeAndHandle(ServletInvocableHandlerMethod.java:102) org.springframework.web.servlet.mvc.method.annotation.RequestMappingHandlerAdapter.invokeHandlerMethod (RequestMappingHandlerAdapter.java:895) org.springframework.web.servlet.mvc.method.annotation.RequestMappingHandlerAdapter.handleInternal (RequestMappingHandlerAdapter.java:800) org.springframework.web.servlet.mvc.method.AbstractHandlerMethodAdapter.handle(AbstractHandlerMethodAdapter.java:87) org.springframework.web.servlet.DispatcherServlet.doDispatch(DispatcherServlet.java:1038) org.springframework.web.servlet.DispatcherServlet.doService(DispatcherServlet.java:942) орг.springframework.web.servlet.FrameworkServlet.processRequest(FrameworkServlet.java:998) org.springframework.web.servlet.FrameworkServlet.doGet(FrameworkServlet.java:890) javax.servlet.http.HttpServlet.service(HttpServlet.java:626) org.springframework.web.servlet.
java:142) org.springframework.web.servlet.mvc.method.annotation.ServletInvocableHandlerMethod.invokeAndHandle(ServletInvocableHandlerMethod.java:102) org.springframework.web.servlet.mvc.method.annotation.RequestMappingHandlerAdapter.invokeHandlerMethod (RequestMappingHandlerAdapter.java:895) org.springframework.web.servlet.mvc.method.annotation.RequestMappingHandlerAdapter.handleInternal (RequestMappingHandlerAdapter.java:800) org.springframework.web.servlet.mvc.method.AbstractHandlerMethodAdapter.handle(AbstractHandlerMethodAdapter.java:87) org.springframework.web.servlet.DispatcherServlet.doDispatch(DispatcherServlet.java:1038) org.springframework.web.servlet.DispatcherServlet.doService(DispatcherServlet.java:942) орг.springframework.web.servlet.FrameworkServlet.processRequest(FrameworkServlet.java:998) org.springframework.web.servlet.FrameworkServlet.doGet(FrameworkServlet.java:890) javax.servlet.http.HttpServlet.service(HttpServlet.java:626) org.springframework.web.servlet. FrameworkServlet.service(FrameworkServlet.java:875) javax.servlet.http.HttpServlet.service(HttpServlet.java:733) орг.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:227) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:53) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.ява: 162) org.apache.catalina.filters.HttpHeaderSecurityFilter.doFilter(HttpHeaderSecurityFilter.java:126) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.servlet.resource.ResourceUrlEncodingFilter.doFilter(ResourceUrlEncodingFilter.java:63) орг.apache.catalina.core.ApplicationFilterChain.
FrameworkServlet.service(FrameworkServlet.java:875) javax.servlet.http.HttpServlet.service(HttpServlet.java:733) орг.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:227) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.apache.tomcat.websocket.server.WsFilter.doFilter(WsFilter.java:53) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.ява: 162) org.apache.catalina.filters.HttpHeaderSecurityFilter.doFilter(HttpHeaderSecurityFilter.java:126) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.servlet.resource.ResourceUrlEncodingFilter.doFilter(ResourceUrlEncodingFilter.java:63) орг.apache.catalina.core.ApplicationFilterChain. internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:101) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:101) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:101) орг.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.
internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:101) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:101) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:101) орг.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework. boot.web.servlet.support.ErrorPageFilter.doFilter(ErrorPageFilter.java:130) org.springframework.boot.web.servlet.support.ErrorPageFilter.access$000(ErrorPageFilter.java:66) org.springframework.boot.web.servlet.support.ErrorPageFilter$1.doFilterInternal(ErrorPageFilter.java:105) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.springframework.boot.web.servlet.support.ErrorPageFilter.doFilter(ErrorPageFilter.java:123) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.ява: 162) org.springframework.boot.actuate.web.trace.servlet.HttpTraceFilter.doFilterInternal(HttpTraceFilter.java:90) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.
boot.web.servlet.support.ErrorPageFilter.doFilter(ErrorPageFilter.java:130) org.springframework.boot.web.servlet.support.ErrorPageFilter.access$000(ErrorPageFilter.java:66) org.springframework.boot.web.servlet.support.ErrorPageFilter$1.doFilterInternal(ErrorPageFilter.java:105) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.springframework.boot.web.servlet.support.ErrorPageFilter.doFilter(ErrorPageFilter.java:123) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.ява: 162) org.springframework.boot.actuate.web.trace.servlet.HttpTraceFilter.doFilterInternal(HttpTraceFilter.java:90) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain. doFilter(ApplicationFilterChain.java:162) орг.springframework.web.filter.RequestContextFilter.doFilterInternal (RequestContextFilter.java: 99) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.FormContentFilter.doFilterInternal (FormContentFilter.java: 92) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.HiddenHttpMethodFilter.doFilterInternal (HiddenHttpMethodFilter.ява:93) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.
doFilter(ApplicationFilterChain.java:162) орг.springframework.web.filter.RequestContextFilter.doFilterInternal (RequestContextFilter.java: 99) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.FormContentFilter.doFilterInternal (FormContentFilter.java: 92) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.HiddenHttpMethodFilter.doFilterInternal (HiddenHttpMethodFilter.ява:93) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org. apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.boot.actuate.metrics.web.servlet.WebMvcMetricsFilter.filterAndRecordMetrics(WebMvcMetricsFilter.java:154) орг.springframework.boot.actuate.metrics.web.servlet.WebMvcMetricsFilter.filterAndRecordMetrics(WebMvcMetricsFilter.java:122) org.springframework.boot.actuate.metrics.web.servlet.WebMvcMetricsFilter.doFilterInternal(WebMvcMetricsFilter.java:107) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) орг.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.CharacterEncodingFilter.doFilterInternal (CharacterEncodingFilter.java:200) org.springframework.web.filter.OncePerRequestFilter.
apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.boot.actuate.metrics.web.servlet.WebMvcMetricsFilter.filterAndRecordMetrics(WebMvcMetricsFilter.java:154) орг.springframework.boot.actuate.metrics.web.servlet.WebMvcMetricsFilter.filterAndRecordMetrics(WebMvcMetricsFilter.java:122) org.springframework.boot.actuate.metrics.web.servlet.WebMvcMetricsFilter.doFilterInternal(WebMvcMetricsFilter.java:107) org.springframework.web.filter.OncePerRequestFilter.doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) орг.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.springframework.web.filter.CharacterEncodingFilter.doFilterInternal (CharacterEncodingFilter.java:200) org.springframework.web.filter.OncePerRequestFilter.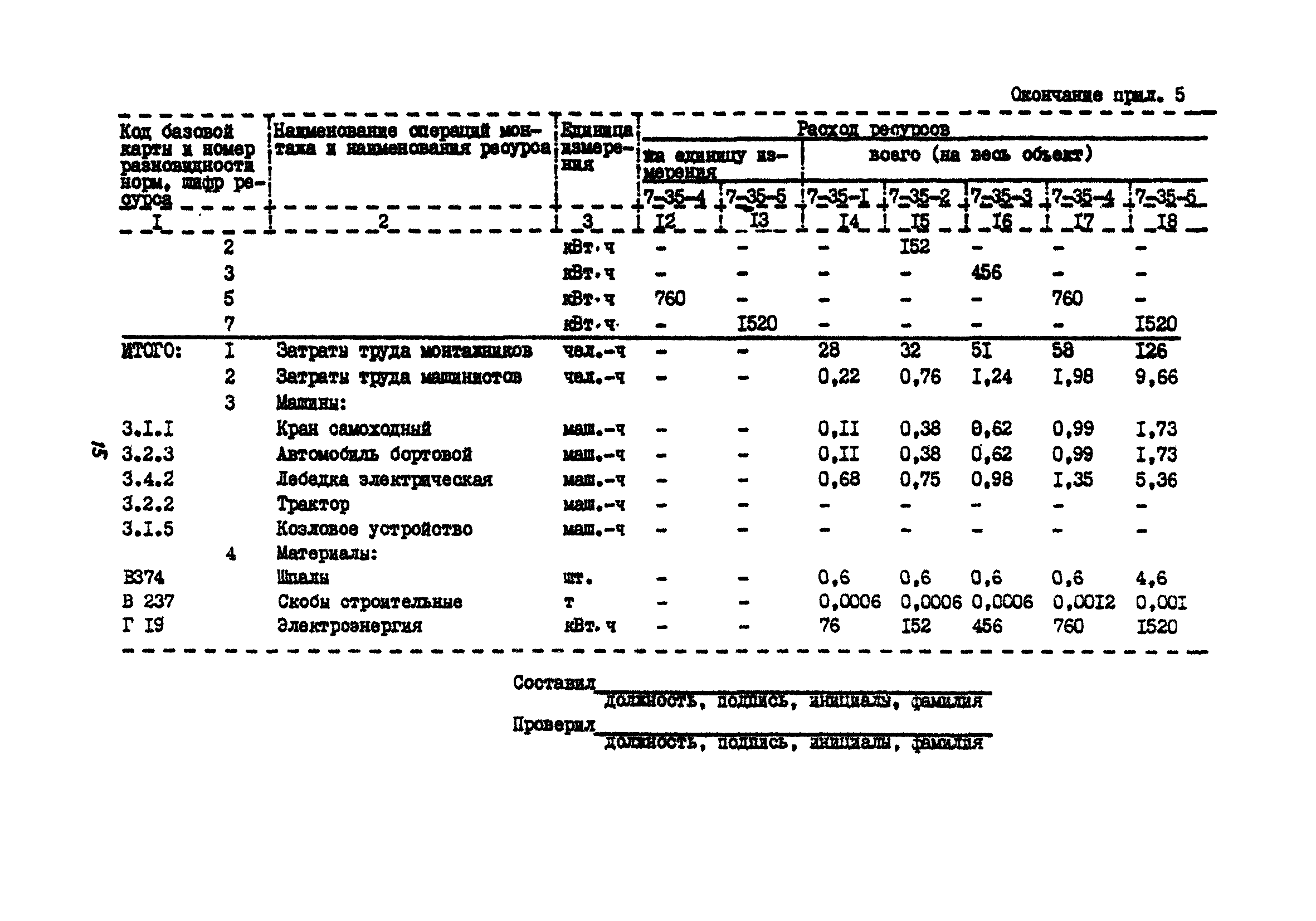 doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.apache.catalina.core.StandardWrapperValve.invoke(StandardWrapperValve.java:202) org.apache.catalina.core.StandardContextValve.invoke(StandardContextValve.java:97) org.apache.catalina.authenticator.AuthenticatorBase.invoke(AuthenticatorBase.java:542) org.apache.catalina.core.StandardHostValve.invoke(StandardHostValve.java:143) org.apache.каталина.клапаны.ErrorReportValve.invoke(ErrorReportValve.java:92) org.apache.catalina.valves.AbstractAccessLogValve.invoke(AbstractAccessLogValve.java:687) org.apache.catalina.core.StandardEngineValve.invoke(StandardEngineValve.java:78) org.apache.catalina.connector.CoyoteAdapter.service(CoyoteAdapter.java:357) org.apache.coyote.http11.Http11Processor.service(Http11Processor.java:374) орг.apache.койот.AbstractProcessorLight.
doFilter(OncePerRequestFilter.java:107) org.apache.catalina.core.ApplicationFilterChain.internalDoFilter(ApplicationFilterChain.java:189) org.apache.catalina.core.ApplicationFilterChain.doFilter(ApplicationFilterChain.java:162) org.apache.catalina.core.StandardWrapperValve.invoke(StandardWrapperValve.java:202) org.apache.catalina.core.StandardContextValve.invoke(StandardContextValve.java:97) org.apache.catalina.authenticator.AuthenticatorBase.invoke(AuthenticatorBase.java:542) org.apache.catalina.core.StandardHostValve.invoke(StandardHostValve.java:143) org.apache.каталина.клапаны.ErrorReportValve.invoke(ErrorReportValve.java:92) org.apache.catalina.valves.AbstractAccessLogValve.invoke(AbstractAccessLogValve.java:687) org.apache.catalina.core.StandardEngineValve.invoke(StandardEngineValve.java:78) org.apache.catalina.connector.CoyoteAdapter.service(CoyoteAdapter.java:357) org.apache.coyote.http11.Http11Processor.service(Http11Processor.java:374) орг.apache.койот.AbstractProcessorLight. process(AbstractProcessorLight.java:65) org.apache.coyote.AbstractProtocol$ConnectionHandler.process(AbstractProtocol.java:893) org.apache.tomcat.util.net.NioEndpoint$SocketProcessor.doRun(NioEndpoint.java:1707) org.apache.tomcat.util.net.SocketProcessorBase.run(SocketProcessorBase.java:49) java.base/java.util.concurrent.ThreadPoolExecutor.runWorker(ThreadPoolExecutor.java:1128) Джава.base/java.util.concurrent.ThreadPoolExecutor$Worker.run(ThreadPoolExecutor.java:628) org.apache.tomcat.util.threads.TaskThread$WrappingRunnable.run(TaskThread.java:61) java.base/java.lang.Thread.run(Thread.java:834)
process(AbstractProcessorLight.java:65) org.apache.coyote.AbstractProtocol$ConnectionHandler.process(AbstractProtocol.java:893) org.apache.tomcat.util.net.NioEndpoint$SocketProcessor.doRun(NioEndpoint.java:1707) org.apache.tomcat.util.net.SocketProcessorBase.run(SocketProcessorBase.java:49) java.base/java.util.concurrent.ThreadPoolExecutor.runWorker(ThreadPoolExecutor.java:1128) Джава.base/java.util.concurrent.ThreadPoolExecutor$Worker.run(ThreadPoolExecutor.java:628) org.apache.tomcat.util.threads.TaskThread$WrappingRunnable.run(TaskThread.java:61) java.base/java.lang.Thread.run(Thread.java:834)
Tim-3 находит свое место в ландшафте иммунотерапии рака
Введение
Т-клеточный иммуноглобулин и домен муцина 3 (Tim-3) (кодируется Havcr2 ) представляет собой клеточную поверхность, содержащую иммуноглобулин (Ig) и домен муцина молекула, которая была первоначально обнаружена как маркер клеточной поверхности, специфичный для интерферона (IFN-γ), продуцирующий CD4 + Т-хелперные 1 (Th2) и CD8 + Т-цитотоксические 1 (Tc1) клетки. 1 Tim-3 является членом семейства генов TIM, расположенных в синтетических хромосомных областях у человека (5q33.2) и мыши (11B1.1), которые связаны как с аллергией, так и с аутоиммунными заболеваниями.2 3 Этот Tim- 3 может функционировать как рецептор, ингибирующий Т-клетки, что было первоначально продемонстрировано Monney . и др. , которые показали, что in vivo введение моноклональных антител Tim-3 (mAbs) усугубляло заболевание в модели экспериментального аутоиммунного энцефаломиелита аутоиммунитета центральной нервной системы.1 Позднее в двух исследованиях было показано, что нарушение взаимодействия Tim-3–Tim-3-лиганд путем введения Tim-3–Ig или Tim-3 mAb приводит к обострению Th2-ответов и развитию аутоиммунного диабета у мышей с диабетом без ожирения.4,5 Однако, несмотря на эти исследования, отсутствие канонического ингибиторного сигнального мотива в цитоплазматическом хвосте Tim-3 поставило под сомнение ингибиторную роль Tim-3. Два недавних исследования, которые демонстрируют связь мутаций зародышевой линии с потерей функции в HAVCR2 с двумя заболеваниями, возникающими в результате гиперактивации Т- и миелоидных клеток, гемофагоцитарным лимфогистиоцитозом (ГЛГ) и подкожной панникулитоподобной Т-клеточной лимфомой (ПТКЛ), подтверждаются.
1 Tim-3 является членом семейства генов TIM, расположенных в синтетических хромосомных областях у человека (5q33.2) и мыши (11B1.1), которые связаны как с аллергией, так и с аутоиммунными заболеваниями.2 3 Этот Tim- 3 может функционировать как рецептор, ингибирующий Т-клетки, что было первоначально продемонстрировано Monney . и др. , которые показали, что in vivo введение моноклональных антител Tim-3 (mAbs) усугубляло заболевание в модели экспериментального аутоиммунного энцефаломиелита аутоиммунитета центральной нервной системы.1 Позднее в двух исследованиях было показано, что нарушение взаимодействия Tim-3–Tim-3-лиганд путем введения Tim-3–Ig или Tim-3 mAb приводит к обострению Th2-ответов и развитию аутоиммунного диабета у мышей с диабетом без ожирения.4,5 Однако, несмотря на эти исследования, отсутствие канонического ингибиторного сигнального мотива в цитоплазматическом хвосте Tim-3 поставило под сомнение ингибиторную роль Tim-3. Два недавних исследования, которые демонстрируют связь мутаций зародышевой линии с потерей функции в HAVCR2 с двумя заболеваниями, возникающими в результате гиперактивации Т- и миелоидных клеток, гемофагоцитарным лимфогистиоцитозом (ГЛГ) и подкожной панникулитоподобной Т-клеточной лимфомой (ПТКЛ), подтверждаются.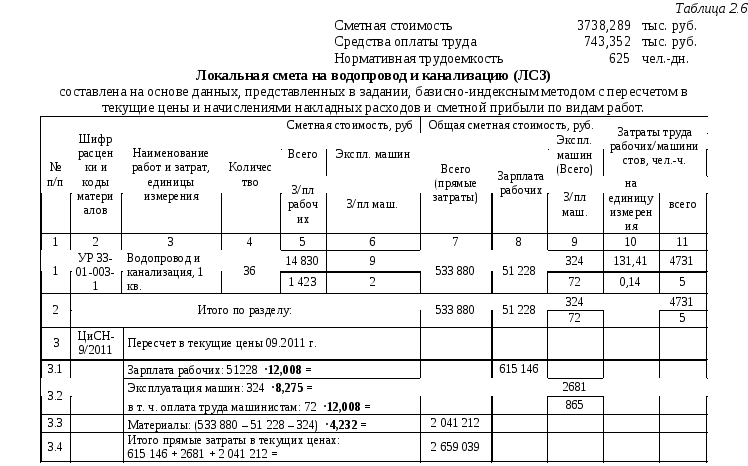 роль Tim-3 как негативного регулятора или «иммунной контрольной точки».6,7 Действительно, Tim-3 корегулируется и коэкспрессируется вместе с другими рецепторами иммунных контрольных точек (PD-1, Lag-3 и TIGIT) на CD4 + и CD8 + Т-клетках8,9. При раке экспрессия Tim-3 специфически маркирует наиболее дисфункциональную или окончательно истощенную подгруппу CD8 + Т-клеток10
,11 В доклинических моделях рака коблокада путей Tim-3 и PD-1 показала замечательную эффективность как при солидных11,12, так и при гематологических опухолях.13 Это привело к исследованию блокады Tim-3 в клинике.Текущие клинические испытания в основном изучают анти-Tim-3 в сочетании с анти-PD-1 при солидных опухолях. Однако поразительные данные ранних испытаний показывают эффективность TIM-3 в сочетании с химиотерапией при миелодиспластическом синдроме (МДС) и остром миелогенном лейкозе (ОМЛ)14, что указывает на его потенциальную ценность при лечении гематологических злокачественных новообразований и заболеваний.
роль Tim-3 как негативного регулятора или «иммунной контрольной точки».6,7 Действительно, Tim-3 корегулируется и коэкспрессируется вместе с другими рецепторами иммунных контрольных точек (PD-1, Lag-3 и TIGIT) на CD4 + и CD8 + Т-клетках8,9. При раке экспрессия Tim-3 специфически маркирует наиболее дисфункциональную или окончательно истощенную подгруппу CD8 + Т-клеток10
,11 В доклинических моделях рака коблокада путей Tim-3 и PD-1 показала замечательную эффективность как при солидных11,12, так и при гематологических опухолях.13 Это привело к исследованию блокады Tim-3 в клинике.Текущие клинические испытания в основном изучают анти-Tim-3 в сочетании с анти-PD-1 при солидных опухолях. Однако поразительные данные ранних испытаний показывают эффективность TIM-3 в сочетании с химиотерапией при миелодиспластическом синдроме (МДС) и остром миелогенном лейкозе (ОМЛ)14, что указывает на его потенциальную ценность при лечении гематологических злокачественных новообразований и заболеваний.
Структура Tim-3 и передача сигналов
Семейство белков TIM представляет собой мембранные белки типа I, которые имеют сходную структуру: вариабельный домен Ig (IgV), гликозилированный домен муцина различной длины и один трансмембранный домен.Все молекулы TIM, за исключением Tim-4, содержат С-концевой цитоплазматический хвост с консервативным сигнальным мотивом на основе тирозина. Интересно, что в отличие от других рецепторов контрольных точек, таких как PD-1 и TIGIT, Tim-3 не имеет классического ингибиторного иммунорецепторного ингибирования на основе тирозина или переключающих сигнальных мотивов на основе иммунорецепторного тирозина в его цитоплазматическом хвосте.
Хотя многое еще предстоит узнать о передаче сигналов Tim-3, известно, что HLA-B-ассоциированный транскрипт 3 (Bat3)15 и белок Fyn16, содержащий домен Sh3 (Src гомология 2), взаимодействуют с консервативными тирозинами Y256 и Y263 в его цитоплазматический хвост.Текущая модель передачи сигналов Tim-3 заключается в том, что при активации Т-клеток Tim-3 рекрутируется в иммунологический синапс17, где Bat3 связывается с цитоплазматическим хвостом Tim-3 и рекрутирует активную каталитическую форму специфической для лимфоцитов протеинтирозинкиназы.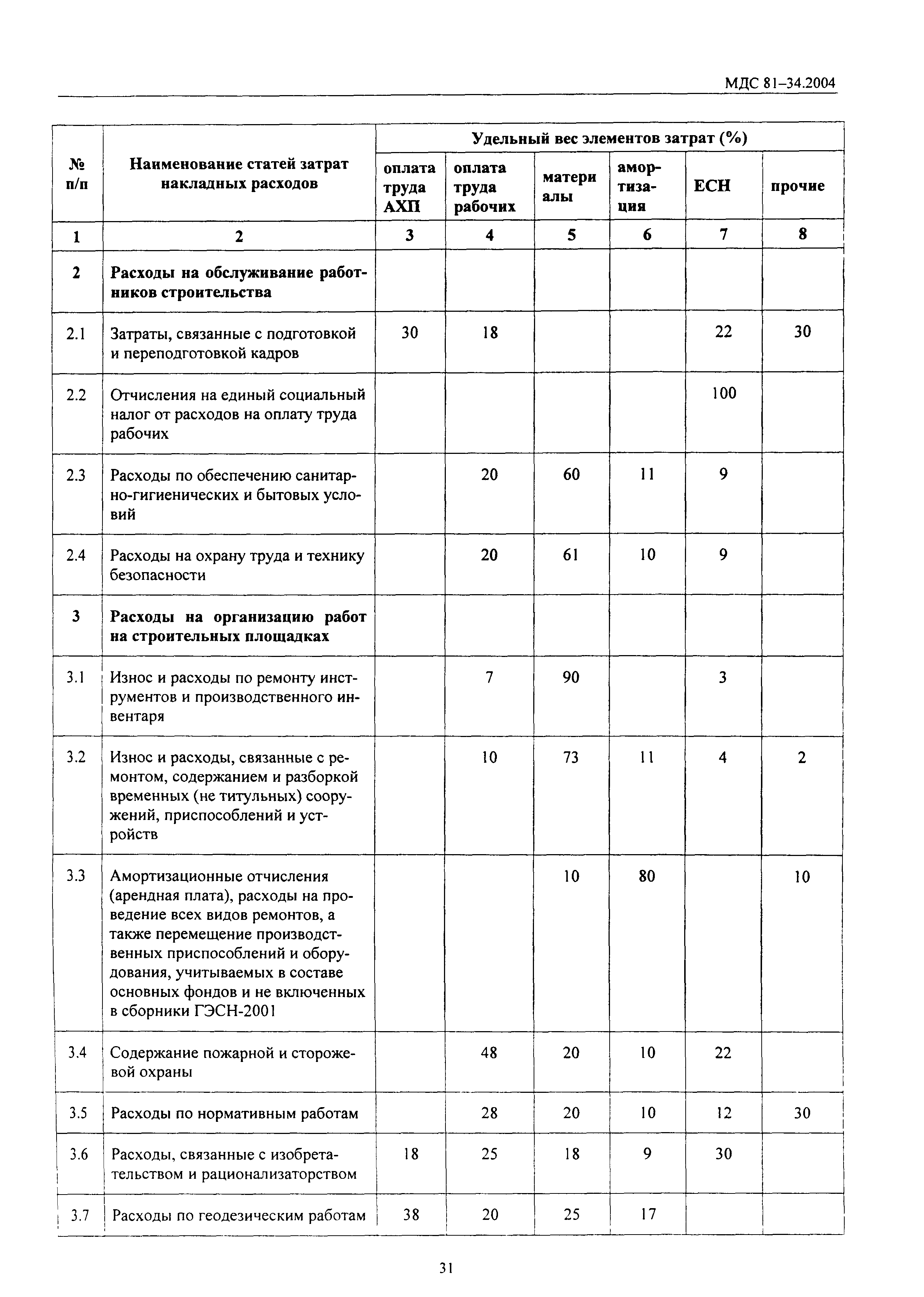 (Lck)15 (рис. 1). Однако, когда Tim-3 взаимодействует с лигандом, консервативные остатки тирозина в цитоплазматическом хвосте фосфорилируются, что приводит к высвобождению Bat3, тем самым позволяя Tim-3 проявлять свою ингибирующую функцию. Было показано, что как галектин-9, так и молекула клеточной адгезии-1, родственная карциноэмбиронному антигену (CEACAM1), два лиганда, описанные для Tim-3 (обсуждается ниже), запускают фосфорилирование Y256 и Y263 тирозинкиназой, индуцируемой интерлейкином-2 T. -клеточная киназа (ITK),18–19 приводящая к высвобождению Bat3.Кроме того, в одном исследовании сообщалось, что экспрессия длинной некодирующей РНК, которая связывает Tim-3 (Lnc-Tim-3), повышалась в дисфункциональных CD8 + Т-клетках пациентов с гепатоцеллюлярной карциномой (ГЦК), и это связывание превращение Lnc-Tim-3 в Tim-3 приводит к высвобождению Bat3, который затем снижает активацию Т-клеток и противоопухолевый иммунитет.20 Следует отметить, что повышенная экспрессия Bat3 блокирует опосредованную Tim-3 ингибирующую передачу сигналов и усиливает функцию эффекторных Т-клеток.
(Lck)15 (рис. 1). Однако, когда Tim-3 взаимодействует с лигандом, консервативные остатки тирозина в цитоплазматическом хвосте фосфорилируются, что приводит к высвобождению Bat3, тем самым позволяя Tim-3 проявлять свою ингибирующую функцию. Было показано, что как галектин-9, так и молекула клеточной адгезии-1, родственная карциноэмбиронному антигену (CEACAM1), два лиганда, описанные для Tim-3 (обсуждается ниже), запускают фосфорилирование Y256 и Y263 тирозинкиназой, индуцируемой интерлейкином-2 T. -клеточная киназа (ITK),18–19 приводящая к высвобождению Bat3.Кроме того, в одном исследовании сообщалось, что экспрессия длинной некодирующей РНК, которая связывает Tim-3 (Lnc-Tim-3), повышалась в дисфункциональных CD8 + Т-клетках пациентов с гепатоцеллюлярной карциномой (ГЦК), и это связывание превращение Lnc-Tim-3 в Tim-3 приводит к высвобождению Bat3, который затем снижает активацию Т-клеток и противоопухолевый иммунитет.20 Следует отметить, что повышенная экспрессия Bat3 блокирует опосредованную Tim-3 ингибирующую передачу сигналов и усиливает функцию эффекторных Т-клеток. .15 Напротив, сниженная экспрессия Bat3 приводит к более сильной ингибирующей передаче сигналов, опосредованной Tim-3.Соответственно, анализ мРНК Bat3 в CD8 + опухолеинфильтрирующих лимфоцитах (TIL), выделенных из колоректальных карцином CT26, показал, что терминально дисфункциональные Tim-3 + PD-1 + CD8 + TIL демонстрируют более 50% снижение уровней мРНК Bat3 по сравнению с Tim-3 — PD-1 + CD8 + TIL, которые все еще сохраняют эффекторную функцию.15 Однако важно отметить, что Bat3-опосредованная регуляция передачи сигналов Tim-3 описана только для Т-клеток.Остается определить, использует ли Tim-3 те же самые нижележащие сигнальные молекулы в других клетках, таких как дендритные клетки (DCs). Действительно, одно исследование показало, что лигирование Tim-3 на DC активирует тирозинкиназу Брутона и c-Src, содержащие домен Sh3, что приводит к инактивации ядерного фактора каппа-легкой цепи-энхансера активированных В-клеток (NF- kB) и впоследствии приводит к ингибированию активации DC21 (рис.
.15 Напротив, сниженная экспрессия Bat3 приводит к более сильной ингибирующей передаче сигналов, опосредованной Tim-3.Соответственно, анализ мРНК Bat3 в CD8 + опухолеинфильтрирующих лимфоцитах (TIL), выделенных из колоректальных карцином CT26, показал, что терминально дисфункциональные Tim-3 + PD-1 + CD8 + TIL демонстрируют более 50% снижение уровней мРНК Bat3 по сравнению с Tim-3 — PD-1 + CD8 + TIL, которые все еще сохраняют эффекторную функцию.15 Однако важно отметить, что Bat3-опосредованная регуляция передачи сигналов Tim-3 описана только для Т-клеток.Остается определить, использует ли Tim-3 те же самые нижележащие сигнальные молекулы в других клетках, таких как дендритные клетки (DCs). Действительно, одно исследование показало, что лигирование Tim-3 на DC активирует тирозинкиназу Брутона и c-Src, содержащие домен Sh3, что приводит к инактивации ядерного фактора каппа-легкой цепи-энхансера активированных В-клеток (NF- kB) и впоследствии приводит к ингибированию активации DC21 (рис. 2).
2).
Модель передачи сигналов Tim-3 в Т-клетках.В отсутствие лиганда Tim-3 Bat-3 связывается с цитоплазматическим хвостом Tim-3 и с каталитически активной формой Lck. Затем Lck фосфорилирует субъединицу CD3ζ комплекса Т-клеточного рецептора (TCR), после чего следует последующее рекрутирование протеинкиназы, ассоциированной с дзета-цепью (ZAP70), в комплекс TCR. Это рекрутирование приводит к активации ZAP70/линкера для активации Т-клеток (LAT)/фосфолипазы С-гамма 1 (PLCγ1)/Ca2+, что способствует пролиферации и выживанию Т-клеток. Однако лигирование Tim-3 лигандом вытесняет Bat-3 из хвоста Tim-3, что приводит к рекрутированию тирозинфосфатаз (CD45 и CD148), что приводит к дефосфорилированию (инактивации) Lck и подавлению ZAP70/LAT/PLCγ1/ Передача сигналов Ca2+ TCR и подавление пролиферации и выживания Т-клеток.Bat-3, HLA-B-ассоциированный транскрипт 3; Ceacam1, молекула клеточной адгезии-1, родственная карциноэмбиронному антигену; Гал-9, галектин-9; Hmgb1, белок группы высокой подвижности B1; PtdSer, фосфатидилсерин; Tim-3, Т-клеточный иммуноглобулин и муциновый домен 3.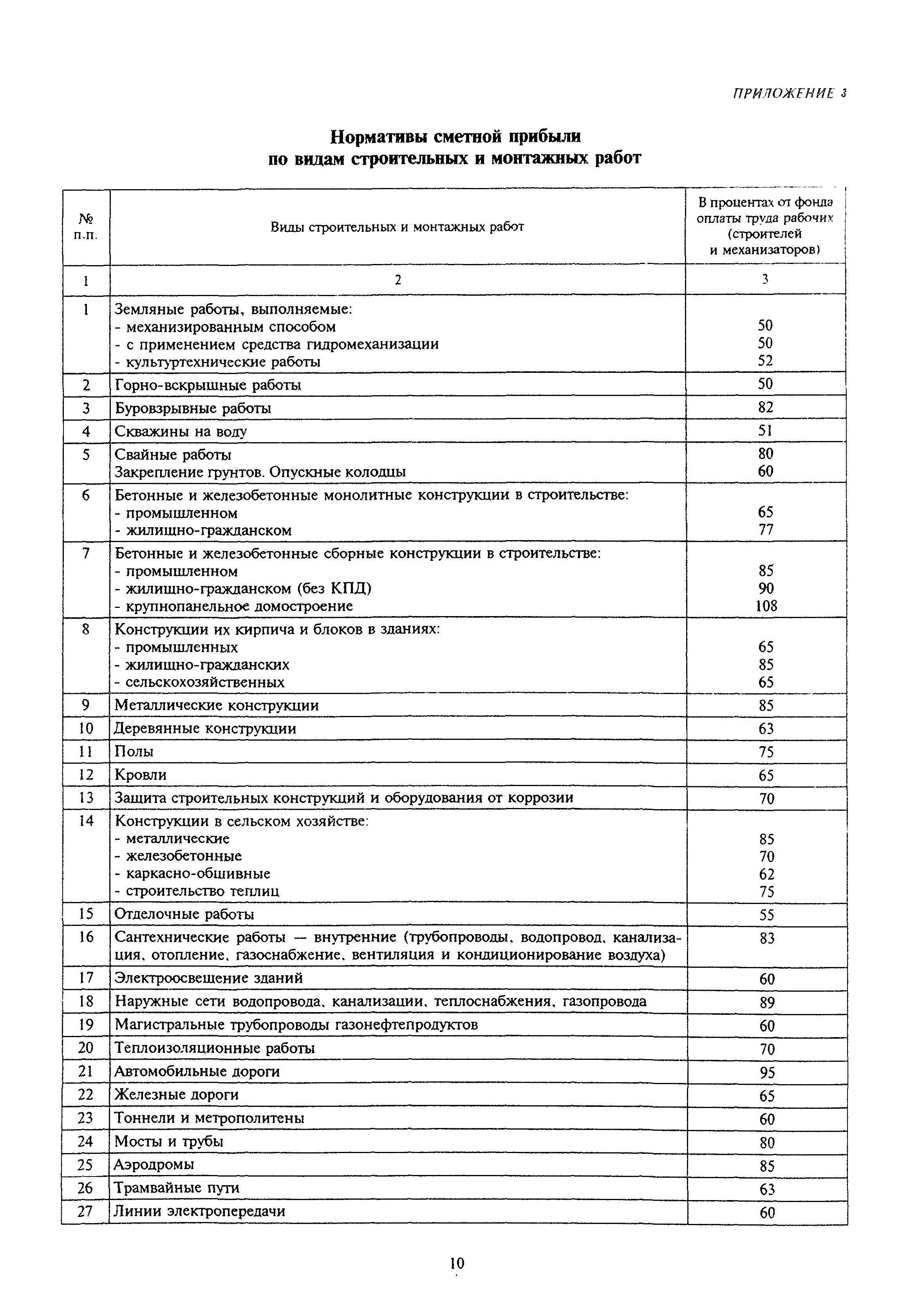
Модель передачи сигналов Tim-3 в DCs HMGB1 может взаимодействовать с несколькими рецепторами либо отдельно, либо в комплексе с ДНК или липополисахаридом (LPS). Рецепторы HMGB1 включают рецептор конечных продуктов активированного гликозилирования (RAGE), TLR4, TLR2 и IL-1R.Комплексы HMGB1-ДНК связываются с RAGE, что приводит к интернализации и активации TLR9 и TLR7 в эндосомах. Это приводит к активации нескольких нижестоящих факторов транскрипции, таких как NF-κB, и активации ассоциированных с опухолью дендритных клеток (TADC). Tim-3 может изолировать HMGB1, что приводит к подавлению опосредованной NF-kB активации DC. Лигирование Tim-3 на DC также активирует Btk и c-Src, которые также ингибируют активацию NF-kB. Опосредованное Tim-3 подавление DC подавляет выработку CXCL9, тем самым снижая рекрутирование CD8 + T-клеток в TME.Bat-3, HLA-B-ассоциированный транскрипт 3; Btk, тирозинкиназа Брутона; DCs, дендритные клетки; HMGB1, белок группы высокой подвижности B1; Tim-3, Т-клеточный иммуноглобулин и муциновый домен 3; ТМО, микроокружение опухоли.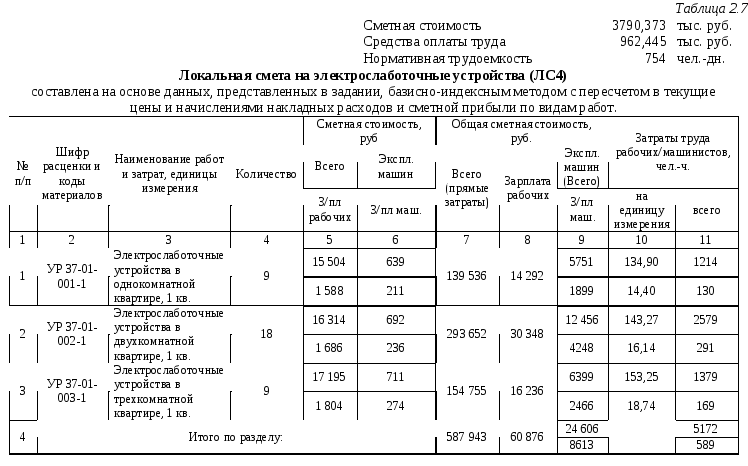
То, что Tim-3 может функционировать как активирующий рецептор, исходит главным образом из исследований in vitro , показывающих, что эктопическая экспрессия Tim-3 на Т-клетках Jurkat приводила к активации Т-клеток в результате повышенной активации NFAT/AP-1.16 Эти Активность Tim-3 происходила без добавления экзогенного лиганда, и исследования структуры/функции показали, что экспрессии Tim-3 на клеточной поверхности может быть достаточно для его способности усиливать активацию Т-клеток.Требования к киназам Src и к ZAP-70 и SLP-76 в Tim-3-опосредованной активации предполагают, что Tim-3 тесно пересекается с сигнальными путями TCR. Однако, как обсуждается далее ниже, ассоциация естественных мутаций потери функции в Tim-3 с патологическим воспалением теперь укрепляет функцию Tim-3 как ингибирующего рецептора.
Лиганды Tim-3
К настоящему времени идентифицировано четыре различных лиганда для Tim-3: галектин-9, фосфатидилсерин (PtdSer), высокоподвижный групповой белок B1 (HMGB1) и CEACAM-1.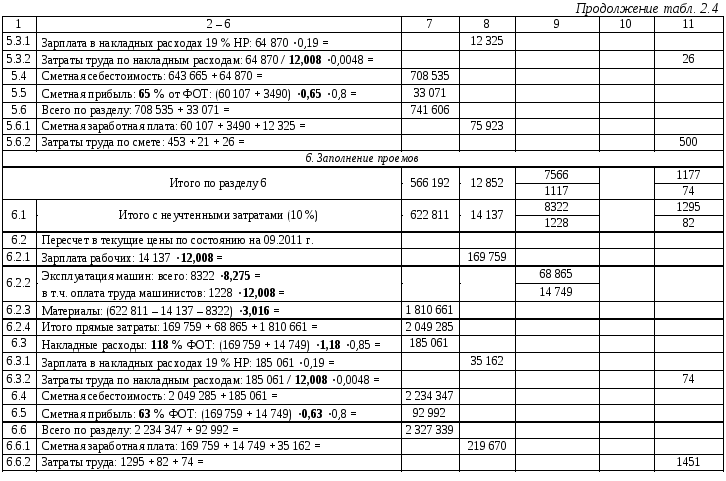 Все они были описаны в контексте рака и имеют отношение к прогрессированию заболевания, как обсуждается ниже.
Все они были описаны в контексте рака и имеют отношение к прогрессированию заболевания, как обсуждается ниже.
Галектин-9
Галектин-9, β-d-галактозидный лектин С-типа млекопитающих с молекулярной массой 36 кДа, был первым лигандом, идентифицированным для Tim-3.22 23 Галектин-9 представляет собой секретируемый белок, который связывается с углеводной структурой на Домен IgV мышиного Tim-3, который имеет два сайта N-связанного гликозилирования.24 Хотя точная структура целевых углеводов, распознаваемых галектином-9, неясна, галектин-9 обладает повышенной аффинностью к более крупным поли- N -ацетилактозаминам. -содержащие конструкции.25 Галектин-9 продуцируется в основном иммунными клетками, включая тучные клетки, Т-клетки, В-клетки, макрофаги, а также неиммунными клетками, включая эпителий желудочно-кишечного тракта, эндотелиальные клетки и фибробласты. Продукция галектина-9 активируется IFN-γ [26, 27] и, таким образом, может быть частью петли отрицательной обратной связи, подобной PD-L1, которая также активируется IFN-γ. 28 Учитывая, что галектин-9 связывает углеводные структуры, он несколько молекул-мишеней. На самом деле дефицит Tim-3 лишь снижает опосредованную галектином-9 гибель клеток Th2 примерно на 40%,24 что позволяет предположить, что некоторые эффекты введения in vivo галектина-9 могут быть опосредованы связыванием галектина-9 с другими рецепторами. чем Тим-3.Действительно, также сообщалось, что галектин-9 выполняет различные биологические функции посредством взаимодействия с CD4429 и IgE.30
28 Учитывая, что галектин-9 связывает углеводные структуры, он несколько молекул-мишеней. На самом деле дефицит Tim-3 лишь снижает опосредованную галектином-9 гибель клеток Th2 примерно на 40%,24 что позволяет предположить, что некоторые эффекты введения in vivo галектина-9 могут быть опосредованы связыванием галектина-9 с другими рецепторами. чем Тим-3.Действительно, также сообщалось, что галектин-9 выполняет различные биологические функции посредством взаимодействия с CD4429 и IgE.30
Как обсуждалось выше, связывание галектина-9 приводит к олигомеризации Tim-3 на клеточной поверхности, что приводит к высвобождению Bat3 из внутриклеточного хвоста Tim-3 (рис. 1). Это, в свою очередь, приводит к ингибированию Т-клеток и может быть одним из механизмов, посредством которых Т-клетки переходят в состояние дисфункции или истощения. Многие линии доказательств указывают на критическую роль взаимодействия Tim-3-galectin-9 в контексте рака.Исследование пациентов с ГЦК, ассоциированным с вирусом гепатита В (HBV), показало, что галектин-9 в высокой степени экспрессируется подмножествами антиген-презентирующих клеток, включая клетки Купфера, миелоидные ДК и плазмацитоидные ДК, и что взаимодействие Tim-3-галектин-9 способствует к иммунной дисфункции и плохому прогнозу.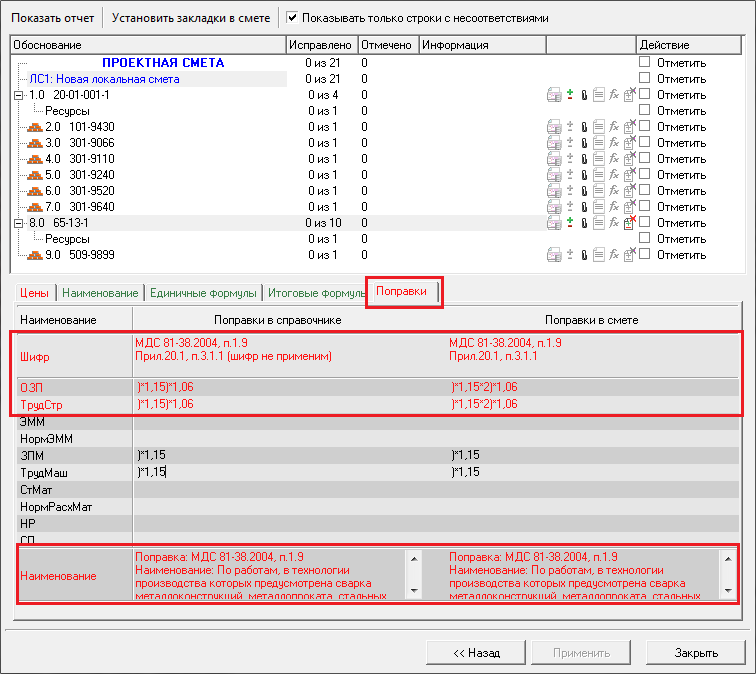 27 При ОМЛ человека аутокринная петля TIM-3-галектин-9 управляет самообновлением стволовых клеток ОМЛ, активируя пути NF-kB и β-катенина 31, а также секрецию обоих TIM-3. а галектин-9 позволяет раковым клеткам уклоняться от иммунного надзора.32 Кроме того, было показано, что трансгенная избыточная экспрессия Tim-3 приводит к увеличению частоты CD11b + Ly-6G + миелоидных супрессорных клеток, которые теряются при делеции галектина-9.33 Наконец, введение анти-Tim-3 и Было показано, что антитела против галектина-9 эквивалентны по своей способности улучшать ответ на химиотерапию паклитакселом (PTX) на моделях рака молочной железы. 34 В совокупности эти данные показывают, что взаимодействие Tim-3-галектин-9 может подавлять иммунные ответы. и способствовать росту опухоли.
27 При ОМЛ человека аутокринная петля TIM-3-галектин-9 управляет самообновлением стволовых клеток ОМЛ, активируя пути NF-kB и β-катенина 31, а также секрецию обоих TIM-3. а галектин-9 позволяет раковым клеткам уклоняться от иммунного надзора.32 Кроме того, было показано, что трансгенная избыточная экспрессия Tim-3 приводит к увеличению частоты CD11b + Ly-6G + миелоидных супрессорных клеток, которые теряются при делеции галектина-9.33 Наконец, введение анти-Tim-3 и Было показано, что антитела против галектина-9 эквивалентны по своей способности улучшать ответ на химиотерапию паклитакселом (PTX) на моделях рака молочной железы. 34 В совокупности эти данные показывают, что взаимодействие Tim-3-галектин-9 может подавлять иммунные ответы. и способствовать росту опухоли.
Однако исследования in vitro показали, что в клетках рака молочной железы галектин-9 подавляет метастатический потенциал, способствуя агрегации раковых клеток, тем самым ограничивая инвазию, отделение от опухоли и прикрепление к эндотелию сосудов. 35, 36 Галектин-9 также было показано, что он индуцирует апоптоз и ингибирует рост клеток HCC.37 Противоположные эффекты галектина-9 на противоопухолевый иммунитет делают прогностическую ценность галектина-9 у онкологических больных неясной. Действительно, положительная экспрессия галектина-9 предсказывала худший клинический исход у пациентов с опухолями мочевыводящих путей38 и немелкоклеточным раком легкого (НМРЛ).39 Однако несколько других исследований показали, что высокая экспрессия галектина-9 способствует лучшему исходу при различных солидных опухолях, таких как рак молочной железы, 36 меланома, 40 ГЦК, 41-43 рак толстой кишки, 44 и уротелиальная карцинома мочевого пузыря. различные эффекты, связанные с связыванием галектина-9 с Tim-3 или углеводными структурами других белков, неизвестны.
35, 36 Галектин-9 также было показано, что он индуцирует апоптоз и ингибирует рост клеток HCC.37 Противоположные эффекты галектина-9 на противоопухолевый иммунитет делают прогностическую ценность галектина-9 у онкологических больных неясной. Действительно, положительная экспрессия галектина-9 предсказывала худший клинический исход у пациентов с опухолями мочевыводящих путей38 и немелкоклеточным раком легкого (НМРЛ).39 Однако несколько других исследований показали, что высокая экспрессия галектина-9 способствует лучшему исходу при различных солидных опухолях, таких как рак молочной железы, 36 меланома, 40 ГЦК, 41-43 рак толстой кишки, 44 и уротелиальная карцинома мочевого пузыря. различные эффекты, связанные с связыванием галектина-9 с Tim-3 или углеводными структурами других белков, неизвестны.
Фосфатидилсерин
PtdSer, фосфолипид, экспонируемый на поверхности апоптотических клеток, служит лигандом для всех членов семейства Tim.45, 46 Несмотря на то, что Tim-3 связывает PtdSer с аффинностью, по крайней мере, в пять раз меньшей по сравнению с другими членами семейства TIM, 47 было продемонстрировано, что взаимодействие Tim-3-PtdSer важно для клиренса апоптотических клеток in vivo и что мыши, получавшие mAb против Tim-3, имеют повышенное количество апоптотических клеток в фолликулах селезенки и повышенный уровень антител против двухцепочечной ДНК в сыворотке. 47 Как взаимодействие Tim-3-PtdSer действует в контексте рака, неясно, особенно с учетом повышенного воздействия. PtdSer в микроокружении опухоли (TME) на раковых клетках из-за множества факторов, включая окислительный стресс48 и эффекты химиотерапии и лучевой терапии.49 Возможно, что взаимодействие Tim-3-PtdSer может быть важным для опосредования фагоцитоза апоптотических клеток с помощью Tim-3-экспрессирующих CD8 + DC и последующей перекрестной презентации антигенов, ассоциированных с апоптотическими клетками, CD8 + T клетки. Однако важно отметить, что PtdSer также связывается с другими рецепторами, включая Mertk и Axl, которые экспрессируются на инфильтрирующих макрофагах и DCs, а также часто экспрессируются на самих опухолевых клетках.50 Кроме того, было показано, что опухолевые клетки меланомы B16 продуцируют микровезикулы, которые экспрессируют PtdSer на внешней поверхности и могут способствовать метастазированию.51 Остается неизвестным, играет ли Tim-3 роль в этом механизме.
47 Как взаимодействие Tim-3-PtdSer действует в контексте рака, неясно, особенно с учетом повышенного воздействия. PtdSer в микроокружении опухоли (TME) на раковых клетках из-за множества факторов, включая окислительный стресс48 и эффекты химиотерапии и лучевой терапии.49 Возможно, что взаимодействие Tim-3-PtdSer может быть важным для опосредования фагоцитоза апоптотических клеток с помощью Tim-3-экспрессирующих CD8 + DC и последующей перекрестной презентации антигенов, ассоциированных с апоптотическими клетками, CD8 + T клетки. Однако важно отметить, что PtdSer также связывается с другими рецепторами, включая Mertk и Axl, которые экспрессируются на инфильтрирующих макрофагах и DCs, а также часто экспрессируются на самих опухолевых клетках.50 Кроме того, было показано, что опухолевые клетки меланомы B16 продуцируют микровезикулы, которые экспрессируют PtdSer на внешней поверхности и могут способствовать метастазированию.51 Остается неизвестным, играет ли Tim-3 роль в этом механизме.
Белок группы высокой подвижности B1
HMGB1, алармин, также может служить лигандом для Tim-3.52 HMGB1, который может секретироваться опухолевыми клетками среди других типов клеток,53 может взаимодействовать с несколькими рецепторами либо самостоятельно, либо в комплексе с ДНК или ЛПС. Рецепторы HMGB1 включают RAGE, TLR4, TLR2 и IL-1R.54 Комплексы HMGB1-ДНК связываются с RAGE, что приводит к интернализации и активации TLR9 и TLR7, локализованных в эндосомах.Такие взаимодействия могут стимулировать провоспалительные и иммуностимулирующие пути, и, следовательно, HMGB1 представляет собой основной клеточный сигнал опасности. Однако комплексообразование HMGB1 с нуклеиновыми кислотами и другими молекулами можно ингибировать прямым взаимодействием с Tim-3 (фиг.2). В моделях рака мышей Chiba и др. показали, что Tim-3 на DCs служит молекулярной ловушкой для HMGB1 и, таким образом, ингибирует рекрутирование нуклеиновых кислот в эндосомы, впоследствии предотвращая активацию DCs в TME. 52 Соответственно, они показали, что блокада Tim-3 может улучшить эффективность ответа на химиотерапию цисплатином, которая, как известно, увеличивает экспрессию HMGB1 в клетках карциномы шейки матки HeLa55 и в клетках карциномы толстой кишки MC38. Важно отметить, что этот эффект оказался независимым. галектина-9. Это открытие представляет интерес в свете демонстрации того, что при раке молочной железы у мышей как антигалектин-9, так и анти-Tim-3 улучшают ответ на PTX,34 который, как также известно, индуцирует высвобождение HMGB1.57 Относительная роль взаимодействий Tim-3-PtdSer и Tim-3-HMGB1 в регуляции ответа на различные химиотерапевтические агенты еще предстоит определить.
52 Соответственно, они показали, что блокада Tim-3 может улучшить эффективность ответа на химиотерапию цисплатином, которая, как известно, увеличивает экспрессию HMGB1 в клетках карциномы шейки матки HeLa55 и в клетках карциномы толстой кишки MC38. Важно отметить, что этот эффект оказался независимым. галектина-9. Это открытие представляет интерес в свете демонстрации того, что при раке молочной железы у мышей как антигалектин-9, так и анти-Tim-3 улучшают ответ на PTX,34 который, как также известно, индуцирует высвобождение HMGB1.57 Относительная роль взаимодействий Tim-3-PtdSer и Tim-3-HMGB1 в регуляции ответа на различные химиотерапевтические агенты еще предстоит определить.
Молекула клеточной адгезии-1, родственная карциноэмбиронному антигену
CEACAM1, который экспрессируется на высоких уровнях на активированных, но не наивных Т-клетках, также является лигандом для Tim-3.19 58 59 Помимо экспрессии Т-клетками, CEACAM1 экспрессируется DCs,60 моноцитами,61 макрофагами62 и опухолевыми клетками, такими как меланома. CEACAM1 может связывать Tim-3 как внутриклеточно, так и внеклеточно.Внутриклеточное связывание важно для созревания белка Tim-3. Соответственно, в мышиной модели колита CEACAM1 -/- Т-клетки экспрессировали пониженные поверхностные уровни Tim-3, что сопровождалось более высокой продукцией эффекторных цитокинов IFN-γ, TNFα и IL-17A.19 Внеклеточное связывание может запускать высвобождение Bat3 из Tim-3, тем самым обеспечивая Tim-3-опосредованное ингибирование передачи сигналов TCR.19 CEACAM1 и Tim-3 в высокой степени экспрессируются на дисфункциональных CD8 + T-клетках в TME.Таким образом, взаимодействие Tim-3-CEACAM1 потенциально может ингибировать иммунные ответы либо в цис-, либо в транс-положении в этих клетках (рис. 1). Важно отметить, что было показано, что CEACAM1 связывается сам с собой63, и данные кристаллографии показывают, что гомотипическое взаимодействие CEACAM1 сильнее, чем взаимодействие CEACAM1–TIM-3.19 Хотя необходимы дальнейшие исследования, чтобы определить физиологические контексты, в которых CEACAM1–CEACAM1 и Взаимодействия CEACAM-Tim-3 работают, антитела против Tim-3, которые продемонстрировали функциональную эффективность in vivo , как было показано, препятствуют связыванию Tim-3 с CEACAM1 и PtdSer.
CEACAM1 может связывать Tim-3 как внутриклеточно, так и внеклеточно.Внутриклеточное связывание важно для созревания белка Tim-3. Соответственно, в мышиной модели колита CEACAM1 -/- Т-клетки экспрессировали пониженные поверхностные уровни Tim-3, что сопровождалось более высокой продукцией эффекторных цитокинов IFN-γ, TNFα и IL-17A.19 Внеклеточное связывание может запускать высвобождение Bat3 из Tim-3, тем самым обеспечивая Tim-3-опосредованное ингибирование передачи сигналов TCR.19 CEACAM1 и Tim-3 в высокой степени экспрессируются на дисфункциональных CD8 + T-клетках в TME.Таким образом, взаимодействие Tim-3-CEACAM1 потенциально может ингибировать иммунные ответы либо в цис-, либо в транс-положении в этих клетках (рис. 1). Важно отметить, что было показано, что CEACAM1 связывается сам с собой63, и данные кристаллографии показывают, что гомотипическое взаимодействие CEACAM1 сильнее, чем взаимодействие CEACAM1–TIM-3.19 Хотя необходимы дальнейшие исследования, чтобы определить физиологические контексты, в которых CEACAM1–CEACAM1 и Взаимодействия CEACAM-Tim-3 работают, антитела против Tim-3, которые продемонстрировали функциональную эффективность in vivo , как было показано, препятствуют связыванию Tim-3 с CEACAM1 и PtdSer. 64
64
Возможно, Tim-3 может связываться с несколькими лигандами одновременно. Связывание Tim-3 с PtdSer или CEACAM-1 не исключает связывания с галектином-9, поскольку сайты связывания находятся на противоположных сторонах IgV-домена Tim-3. Недавно опубликованная кристаллическая структура человеческого TIM-3 определила различные потенциальные сайты гликозилирования между мышиным (Thr44, Asn74 и Asn100) и человеческим (Asn33, Asn100 и Asn124) TIM-3.65 Авторы предполагают, что модификации углеводной боковой цепи в Asn124 могут изменяют взаимодействие TIM-3 человека с лигандами, которые связывают поверхность GFCC, такими как PtdSer, и, соответственно, антитела, которые блокируют взаимодействия TIM-3 человека с лигандами на поверхности GFCC, также могут блокировать TIM-3-галектин-9 взаимодействие.Кроме того, учитывая, что галектин-9 имеет два идентичных домена распознавания углеводов, было высказано предположение, что галектин-9 может служить для агрегации комплексов Tim-3-PtdSer или Tim-3-CEACAM1, тем самым способствуя передаче сигналов Tim-3. Преобладание экспрессии CEACAM-1, PtdSer или galectin-9 может быть ключевым фактором, определяющим передачу сигналов Tim-3 в данной ткани.
Преобладание экспрессии CEACAM-1, PtdSer или galectin-9 может быть ключевым фактором, определяющим передачу сигналов Tim-3 в данной ткани.
Роль Tim-3 в TME
TME гетерогенна и включает разные типы клеток. Что известно об экспрессии и функции Tim-3 в различных типах инфильтрирующих опухоль клеток, обсуждается ниже.
Tim-3 на Т-клетках
CD8 + Т-клетки являются ключевыми медиаторами клиренса опухоли. Однако хроническая активация в присутствии супрессивных сигналов в TME толкает CD8 + Т-клетки в клеточное состояние, обычно описываемое как дисфункция или истощение. Дисфункциональные Т-клетки характеризуются дефицитом цитотоксичности, продукции провоспалительных цитокинов и высокой экспрессией нескольких рецепторов контрольных точек. Примечательно, что Tim-3 маркирует наиболее терминально дисфункциональную подгруппу CD8 + TIL.11, 66 Хотя точный механизм, с помощью которого Tim-3 способствует терминальной дисфункции в CD8 + T-клетках, неясен, заманчиво предположить, что Tim-3 снижает стволовость CD8 + T-клеток, противодействуя TCF-1, который, как известно, поддерживает стволовость и сдерживает эффекторную дифференцировку..jpg) 67 В отличие от PD-1, который экспрессируется вместе с TCF-1 на стволоподобных CD8 + Т-клетках в TME, экспрессия Tim-3 сильно антикоррелирует с TCF-1. экспрессия.68 Потенциальная регуляторная взаимосвязь между Tim-3 и TCF-1 клинически значима, учитывая положительную корреляцию TCF-1 + CD8 + Т-клеток с ответом на иммунотерапию блокадой контрольных точек у пациентов с меланомой,69 что потеря TCF -1 + в CD8 + Т-клетках ограничивает ответ на блокаду контрольных точек в доклинических моделях рака,70,71 и что экспрессия Tim-3 является отрицательным прогностическим маркером при некоторых видах рака (обсуждается ниже).
67 В отличие от PD-1, который экспрессируется вместе с TCF-1 на стволоподобных CD8 + Т-клетках в TME, экспрессия Tim-3 сильно антикоррелирует с TCF-1. экспрессия.68 Потенциальная регуляторная взаимосвязь между Tim-3 и TCF-1 клинически значима, учитывая положительную корреляцию TCF-1 + CD8 + Т-клеток с ответом на иммунотерапию блокадой контрольных точек у пациентов с меланомой,69 что потеря TCF -1 + в CD8 + Т-клетках ограничивает ответ на блокаду контрольных точек в доклинических моделях рака,70,71 и что экспрессия Tim-3 является отрицательным прогностическим маркером при некоторых видах рака (обсуждается ниже).
Помимо CD8 + TIL, Tim-3 также экспрессируется на более высоких уровнях CD4 + регуляторными Т-клетками (T reg ) как в опухолях человека, так и в опухолях мыши по сравнению с T reg , присутствующими в опухоли дренирование лимфатических узлов, селезенки или крови. 72–74 Важно отметить, что Tim-3 + Treg демонстрируют более супрессивный фенотип.74 Gao и др. продемонстрировали, что примерно 70% TIL Tim-3 + CD4 + экспрессировали Foxp3 и около 60% TIL Foxp3 + были TIM-3 + , и что присутствие Tim-3 + Treg коррелировало с далеко зашедшей стадией опухоли и наличием узловых метастазов у больных НМРЛ.73 Как передача сигналов Tim-3 влияет на функциональный фенотип CD8 + T-клеток и Treg в TME, до конца не известно, и для исследования потребуется использование клонально-специфических мутантных мышей.
72–74 Важно отметить, что Tim-3 + Treg демонстрируют более супрессивный фенотип.74 Gao и др. продемонстрировали, что примерно 70% TIL Tim-3 + CD4 + экспрессировали Foxp3 и около 60% TIL Foxp3 + были TIM-3 + , и что присутствие Tim-3 + Treg коррелировало с далеко зашедшей стадией опухоли и наличием узловых метастазов у больных НМРЛ.73 Как передача сигналов Tim-3 влияет на функциональный фенотип CD8 + T-клеток и Treg в TME, до конца не известно, и для исследования потребуется использование клонально-специфических мутантных мышей.
Tim-3 в не-Т-клетках
Дендритные клетки
Tim-3 конститутивно экспрессируется на ДК. В частности, экспрессия Tim-3 является самой высокой в клетках cDC134 (CD103 + у мыши, CD141 + у человека), которые перекрестно представляют антиген и лицензируют CD8 + Т-клеток.75, 76 Хотя роль Tim-3 в ДК до сих пор неясна, исследования на доклинических моделях показали, что Tim-3 может подавлять внутриклеточную TLR-индуцированную активацию, как описано выше52, и что эффект блокады Tim-3 в улучшении ответа на химиотерапию требует DCs. 34,52 В модели рака молочной железы у мышей лечение анти-Tim-3 связано со стимулированием продукции CXCL9 опухолевым cDC1, что, в свою очередь, увеличивает инфильтрацию и активацию лимфоцитов.34 Интересно, что антитела, направленные против галектина-9, но не HMGB1 или CEACAM-1, стимулировали секрецию CXCL9 опухолевыми cDC1.34 В этом отношении было показано, что лигирование Tim-3 ослабляет активацию NF-kB и, таким образом, ингибирует созревание мышиных DCs21 (рис. 2). То, как Tim-3 влияет на функциональный фенотип DC и роль взаимодействий с галектином-9, CEACAM-1 и HMGB1 в этом процессе, потребует тщательного вскрытия и использования мышей с условным нокаутом, специфичных для линии, а также реагентов, которые блокируют специфический лиганд. взаимодействия.
34,52 В модели рака молочной железы у мышей лечение анти-Tim-3 связано со стимулированием продукции CXCL9 опухолевым cDC1, что, в свою очередь, увеличивает инфильтрацию и активацию лимфоцитов.34 Интересно, что антитела, направленные против галектина-9, но не HMGB1 или CEACAM-1, стимулировали секрецию CXCL9 опухолевыми cDC1.34 В этом отношении было показано, что лигирование Tim-3 ослабляет активацию NF-kB и, таким образом, ингибирует созревание мышиных DCs21 (рис. 2). То, как Tim-3 влияет на функциональный фенотип DC и роль взаимодействий с галектином-9, CEACAM-1 и HMGB1 в этом процессе, потребует тщательного вскрытия и использования мышей с условным нокаутом, специфичных для линии, а также реагентов, которые блокируют специфический лиганд. взаимодействия.
Макрофаги
Одно исследование показало, что повышенная экспрессия Tim-3 способствует поляризации макрофагов M2 в мышиной модели рака, связанного с колитом.Используя клетки RAW264.7, авторы продемонстрировали, что STAT1 является сигнальным адаптером Tim-3 в макрофагах и что Tim-3 контролирует поляризацию макрофагов, ингибируя сигнальную ось STAT1-miR-155. 77 Таким образом, Tim-3 может дополнительно способствовать развитию опухоли. прогрессирование путем стимуляции супрессивного фенотипа макрофагов.
77 Таким образом, Tim-3 может дополнительно способствовать развитию опухоли. прогрессирование путем стимуляции супрессивного фенотипа макрофагов.
NK-клетки
Натуральные клетки-киллеры (NK) конститутивно экспрессируют Tim-3. Блокада TIM-3 в NK-клетках, полученных от пациентов с метастатической меланомой, приводила к снижению цитотоксичности и продукции IFN-γ in vitro .78 У пациентов с аденокарциномой легкого высокая экспрессия TIM-3 как на CD3 — CD56 + NK-клетках, так и на CD56(dim) NK-клетках независимо коррелировала с более короткой общей выживаемостью (ОВ) пациентов с аденокарциномой легкого, что указывает на что экспрессия TIM-3 в Nk-клетках может функционировать как прогностический биомаркер при этом заболевании. 79 Опять же, блокада передачи сигналов Tim-3 с помощью моноклональных антител против TIM-3 приводила к повышенной цитотоксичности и продукции IFN-γ периферическими NK-клетками у этих пациентов. .Хотя блокада TIM-3, по-видимому, усиливает цитолитическую функцию циркулирующих NK-клеток, роль TIM-3 в активизации инфильтрирующих опухоль NK-клеток еще предстоит продемонстрировать. В совокупности эти исследования показывают, что TIM-3 может также функционировать в качестве рецептора контрольной точки на NK-клетках.
В совокупности эти исследования показывают, что TIM-3 может также функционировать в качестве рецептора контрольной точки на NK-клетках.
Регуляция экспрессии Tim-3
Несколько факторов транскрипции вовлечены в стимуляцию экспрессии Tim-3 на Т-клетках. Первым идентифицированным был T-bet; действительно, было продемонстрировано, что T-bet связывается с промотором Tim-3.80 Впоследствии было продемонстрировано, что Nfil3 (ядерный фактор, регулируемый интерлейкин 3) может дополнительно усиливать эффект t-bet на экспрессию Tim-3 путем ремоделирования локуса Tim-3 и делая его более восприимчивым к T-bet. 81 Интересно, что Nfil3 индуцируется IL-27,81, который также индуцирует c-maf и prdm1, чтобы управлять экспрессией модуля рецепторов контрольных точек, включая Tim-3.8 Кроме того, другие сигналы в TME могут взаимодействовать с IL-27, чтобы управлять экспрессией Tim-3. . Наши неопубликованные данные показывают, что передача сигналов глюкокортикоидов может взаимодействовать с IL-27, чтобы способствовать экспрессии Tim-3 на CD8 + Т-клетках.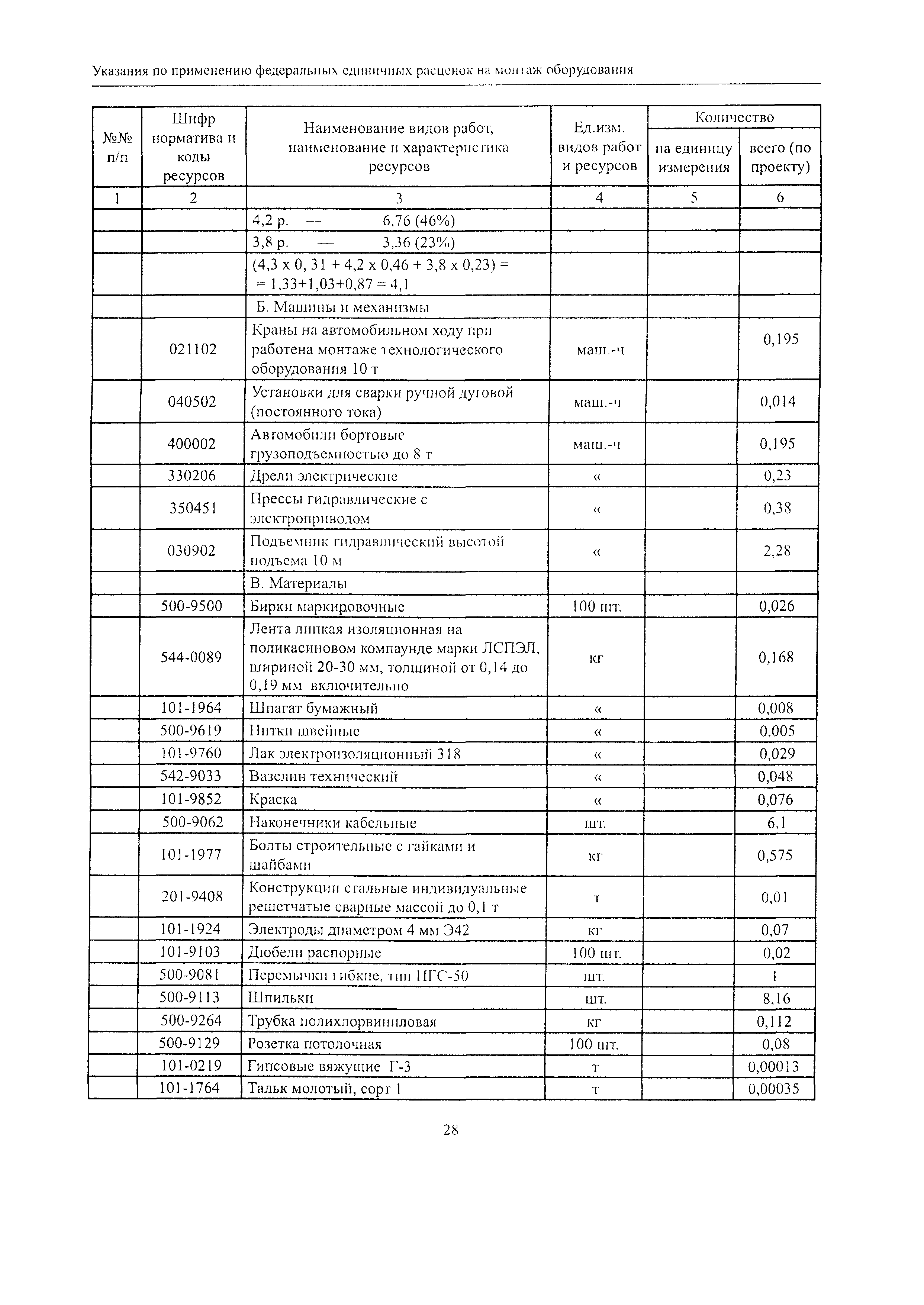 Наконец, одно исследование показало, что IL-35, который имеет общую субъединицу Ebi3 с IL-27, также может индуцировать экспрессию Tim-3 наряду с другими рецепторами контрольных точек.82 Примечательно, что во всех этих исследованиях изучались Т-клетки. Неизвестно, регулируется ли сходным образом экспрессия Tim-3 в других типах клеток.
Наконец, одно исследование показало, что IL-35, который имеет общую субъединицу Ebi3 с IL-27, также может индуцировать экспрессию Tim-3 наряду с другими рецепторами контрольных точек.82 Примечательно, что во всех этих исследованиях изучались Т-клетки. Неизвестно, регулируется ли сходным образом экспрессия Tim-3 в других типах клеток.
Генетические изменения Tim-3
TIM-3 человека локализован на хромосоме 5q33.3, которая содержит большое количество однонуклеотидных полиморфизмов.3 Полиморфизмы TIM-3 (-1516 G/T (rs10053538) и -574 G/ T (rs10515746) в промоторной области и +4259 T/G (rs1036199) в кодирующей области) были связаны с повышенным риском рака.Полиморфизм промоторной области TIM-3 (-1516 G/T, -882 C/T и -574 G/T) показал связь с повышенной восприимчивостью к раку желудка.83 Полиморфизм TIM-3–574 G/T показал связь с риск развития тимомы, связанной с миастенией гравис,84 и TIM-3–1516 G/T показали связь с повышенной восприимчивостью к раку молочной железы и прогрессированием рака молочной железы. 85
85
Кроме того, два недавних исследования демонстрируют, что мутации зародышевой линии с потерей функции в HAVCR2 приводят к гиперактивации Т- и миелоидных клеток, что приводит к двум воспалительным заболеваниям, ГЛГ и СПТКЛ.6 7 Мутации расположены в домене IgV Tim-3 и приводят к неправильной укладке белка Tim-3. Неправильно свернутый белок агрегирует внутриклеточно, что приводит к потере экспрессии Tim-3 на клеточной поверхности как Т-клеток, так и миелоидных клеток. Пациенты с этими мутациями демонстрируют тяжелый аутоиммунный фенотип, характеризующийся избыточной продукцией провоспалительных молекул CXCL10, IL-1β, IL-18 и растворимого CD25. То, что мутации потери функции Tim-3 приводят к заболеванию, способствующему воспалению, подтверждает ингибирующую функцию Tim-3.
Tim-3 как прогностический маркер при раке
Учитывая его ингибирующее действие на несколько типов клеток, неудивительно, что несколько исследований показали, что экспрессия Tim-3 является отрицательным прогностическим биомаркером при некоторых типах опухолей.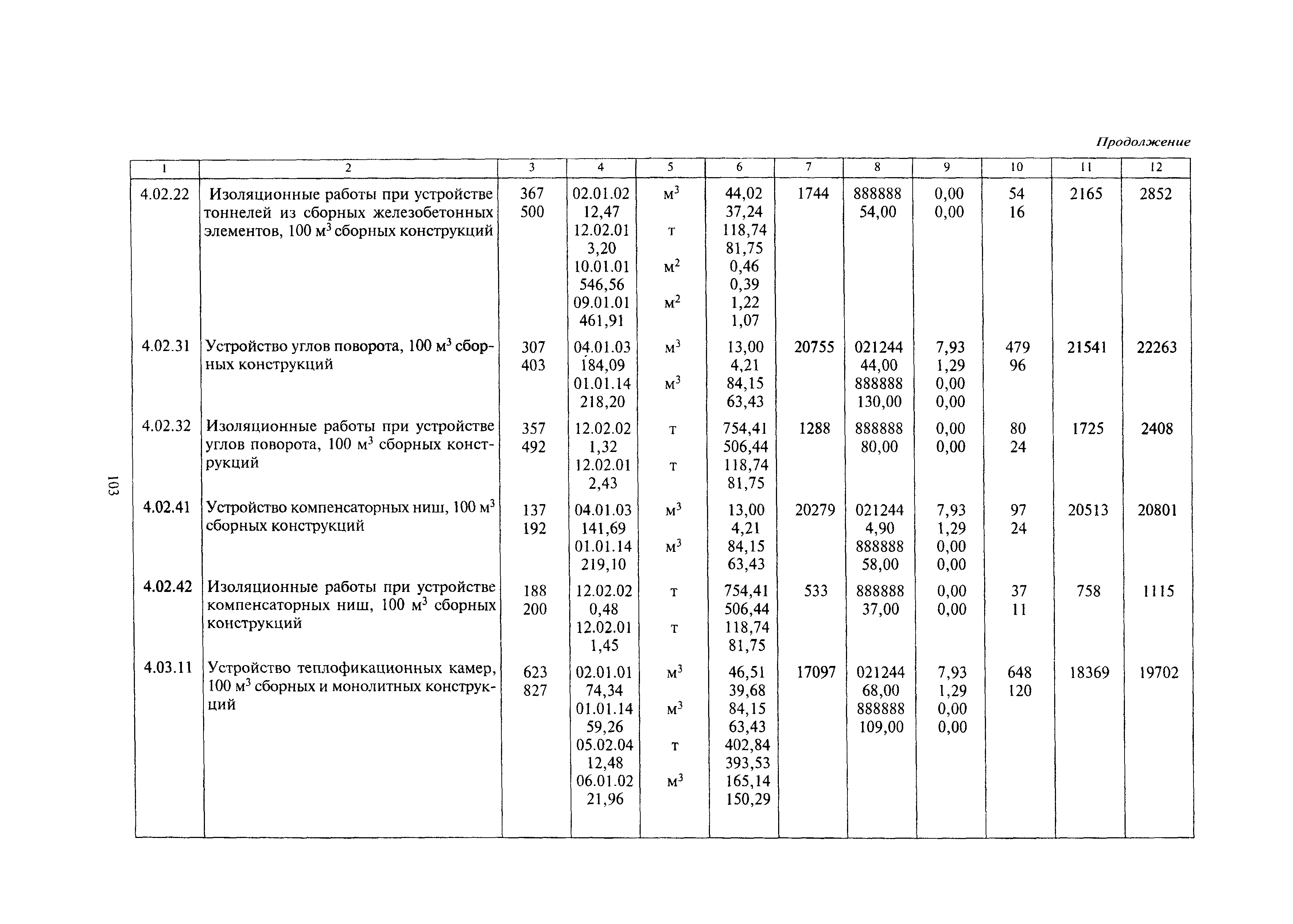 Как обсуждалось выше, наличие TIM-3 + Treg коррелирует с плохими клиническими параметрами при НМРЛ.73 Аналогичным образом, Komohara и др. продемонстрировали, что TIM-3 в высокой степени экспрессируется на CD204 + ассоциированных с опухолью макрофагах и опухолевых клетках у пациентов со светлоклеточной почечно-клеточной карциномой и что более высокий уровень экспрессии TIM-3 положительно коррелирует с более короткой выживаемостью без прогрессирования в этих пациенты.86 Ли и др. сообщалось, что экспрессия TIM-3 была увеличена как на CD4 + , так и на CD8 + Т-клетках в HBV-ассоциированном HCC по сравнению с соседними тканями, и что количество TIM-3 + инфильтрирующих опухоль клеток было отрицательным. связаны с выживанием пациентов. Кроме того, экспрессия TIM-3 была связана с прогрессирующей стадией метастазирования опухолевых узлов (TNM) при нескольких различных типах рака, включая рак желудка87, рак толстой кишки88 и рак шейки матки.
Как обсуждалось выше, наличие TIM-3 + Treg коррелирует с плохими клиническими параметрами при НМРЛ.73 Аналогичным образом, Komohara и др. продемонстрировали, что TIM-3 в высокой степени экспрессируется на CD204 + ассоциированных с опухолью макрофагах и опухолевых клетках у пациентов со светлоклеточной почечно-клеточной карциномой и что более высокий уровень экспрессии TIM-3 положительно коррелирует с более короткой выживаемостью без прогрессирования в этих пациенты.86 Ли и др. сообщалось, что экспрессия TIM-3 была увеличена как на CD4 + , так и на CD8 + Т-клетках в HBV-ассоциированном HCC по сравнению с соседними тканями, и что количество TIM-3 + инфильтрирующих опухоль клеток было отрицательным. связаны с выживанием пациентов. Кроме того, экспрессия TIM-3 была связана с прогрессирующей стадией метастазирования опухолевых узлов (TNM) при нескольких различных типах рака, включая рак желудка87, рак толстой кишки88 и рак шейки матки. 89 Следует отметить, что метаанализ ОВ пациентов с солидными опухолями показал, что более высокая экспрессия TIM-3 значительно коррелирует с более короткой ОВ.90
89 Следует отметить, что метаанализ ОВ пациентов с солидными опухолями показал, что более высокая экспрессия TIM-3 значительно коррелирует с более короткой ОВ.90
TIM-3 при ОМЛ и МДС
Две независимые группы определили, что TIM-3 экспрессируется на большинстве CD34 + CD38 − лейкозных стволовых клеток (LSCs) и CD34 + CD38 + лейкемических клеток-предшественников в ОМЛ человека, но не в нормальных гемопоэтических стволовых клетках (ГСК) CD34 + CD38 − .91, 92 Экспрессия TIM-3 также была описана на бластах при МДС, и было обнаружено, что она коррелирует с прогрессированием заболевания.93 Активация TIM-3 также связана с лейкемической трансформацией предлейкемических заболеваний, включая МДС и миелопролиферативные новообразования, такие как хронический миелогенный лейкоз. 31
Функциональные доказательства ключевой роли TIM-3 в ОМЛ были получены при использовании анти-ADCC (антителозависимая клеточная цитотоксичность) и CDC (комплементзависимая клеточная цитотоксичность) компетентных антител против TIM-3, которые ингибировали приживление и развитие человеческого ОМЛ у иммунодефицитных мышей-хозяев. 31 В соответствии с наблюдениями на доклинических моделях солидных опухолей, было показано, что двойная блокада TIM-3 и PD-1 значительно снижает опухолевую массу и продлевает выживаемость в сингенной модели ОМЛ на мышах. Сообщается, что TIM-3 способствует аутокринному стимулирующая петля через взаимодействие TIM-3-galectin-9, которое поддерживает самообновление LSC31 (рис. 3). Было показано, что TIM-3 + LSC и бласты активно секретируют галектин-9. Было показано, что лигирование галектина-9 клеток TIM-3 + первичного пациента стимулирует путь NF-κB, индуцируя фосфорилирование киназ, регулируемых внеклеточными сигналами (ERK) и AKT, а также увеличивает транслокацию β-катенина в ядро.31 Эта аутокринная петля обратной связи TIM-3-galectin-9 может поддерживать клональную селекцию предлейкемических HSC, которые перерастают нормальные HSC и могут способствовать трансформации в миелоидные LSC/способствовать их самообновлению.
31 В соответствии с наблюдениями на доклинических моделях солидных опухолей, было показано, что двойная блокада TIM-3 и PD-1 значительно снижает опухолевую массу и продлевает выживаемость в сингенной модели ОМЛ на мышах. Сообщается, что TIM-3 способствует аутокринному стимулирующая петля через взаимодействие TIM-3-galectin-9, которое поддерживает самообновление LSC31 (рис. 3). Было показано, что TIM-3 + LSC и бласты активно секретируют галектин-9. Было показано, что лигирование галектина-9 клеток TIM-3 + первичного пациента стимулирует путь NF-κB, индуцируя фосфорилирование киназ, регулируемых внеклеточными сигналами (ERK) и AKT, а также увеличивает транслокацию β-катенина в ядро.31 Эта аутокринная петля обратной связи TIM-3-galectin-9 может поддерживать клональную селекцию предлейкемических HSC, которые перерастают нормальные HSC и могут способствовать трансформации в миелоидные LSC/способствовать их самообновлению.
Модель механизма действия mAb Tim-3 при ОМЛ/МДС. Взаимодействие Tim-3-galectin-9 способствует самообновлению аутокринных лейкозных стволовых клеток (LSC). Блокада взаимодействия Tim-3-galectin-9 может напрямую ингибировать нижестоящие сигнальные пути, которые способствуют самообновлению стволовых клеток, включая пути NF-kB и β-catenin.В качестве альтернативы и/или дополнительно связывание анти-TIM-3 антитела с TIM-3 на поверхности LSC/бластов может способствовать антителозависимому клеточному фагоцитозу (ADCP) миелоидными клетками/макрофагами, экспрессирующими FcγR, и продвижению фенотипа M1. Tim-3, Т-клеточный иммуноглобулин и домен муцина 3.
Взаимодействие Tim-3-galectin-9 способствует самообновлению аутокринных лейкозных стволовых клеток (LSC). Блокада взаимодействия Tim-3-galectin-9 может напрямую ингибировать нижестоящие сигнальные пути, которые способствуют самообновлению стволовых клеток, включая пути NF-kB и β-catenin.В качестве альтернативы и/или дополнительно связывание анти-TIM-3 антитела с TIM-3 на поверхности LSC/бластов может способствовать антителозависимому клеточному фагоцитозу (ADCP) миелоидными клетками/макрофагами, экспрессирующими FcγR, и продвижению фенотипа M1. Tim-3, Т-клеточный иммуноглобулин и домен муцина 3.
Клиническое развитие антител TIM-3
Обширные данные по доклиническим моделям рака11–13 и культурам in vitro с образцами пациентов10, показывающие преимущество блокирования Tim-3, особенно в сочетании с блокадой PD-1, улучшение противоопухолевого иммунитета способствовало развитию Tim-3 в качестве иммунотерапевтической мишени.Кроме того, повышенная регуляция TIM-3 была связана с развитием устойчивости к блокаде PD-1 как в образцах пациентов с раком легких, так и в моделях рака легких, а также в образцах пациентов с раком головы и шеи. 94, 95 Впервые у человека Клинические испытания фазы 1/2 были начаты со многими антителами TIM-3 (таблица 1), включая TSR-022 (NCT02817633), MBG453 (NCT02608268) и LY3321367 (NCT03099109), для которых сообщалось о ранних клинических данных. Многие из этих антител против TIM-3 тестируются в сочетании с mAb против PD-1/L1.Важно отметить, что ранние данные показали, что эта комбинация в целом безопасна и хорошо переносится. В соответствии с доклиническими данными, показывающими эффективность анти-Tim-3 + анти-PD-1, TSR-022 в комбинации с анти-PD-1 (TSR-042) продемонстрировал активность у пациентов с НМРЛ, у которых прогрессировало предшествующее лечение анти-PD-1. ПД-1 терапия. Кроме того, LY3321367 продемонстрировал активность одного агента с частичным ответом у пациента с мелкоклеточным раком легкого при дозе 1200 мг каждые 2 недели.
94, 95 Впервые у человека Клинические испытания фазы 1/2 были начаты со многими антителами TIM-3 (таблица 1), включая TSR-022 (NCT02817633), MBG453 (NCT02608268) и LY3321367 (NCT03099109), для которых сообщалось о ранних клинических данных. Многие из этих антител против TIM-3 тестируются в сочетании с mAb против PD-1/L1.Важно отметить, что ранние данные показали, что эта комбинация в целом безопасна и хорошо переносится. В соответствии с доклиническими данными, показывающими эффективность анти-Tim-3 + анти-PD-1, TSR-022 в комбинации с анти-PD-1 (TSR-042) продемонстрировал активность у пациентов с НМРЛ, у которых прогрессировало предшествующее лечение анти-PD-1. ПД-1 терапия. Кроме того, LY3321367 продемонстрировал активность одного агента с частичным ответом у пациента с мелкоклеточным раком легкого при дозе 1200 мг каждые 2 недели.
Клинические испытания анти-Tim-3
Учитывая экспрессию TIM-3 на LSC и бластах при ОМЛ и МДС и отсутствие экспрессии на HSC, антитело против TIM-3 MBG453 тестировали в комбинации со стандартным лечения гипометилирующими агентами децитабином или азацитидином в многоцентровом открытом исследовании фазы Ib с повышением дозы (NCT03066648) у пациентов с МДС или ОМЛ высокого риска и без предшествующей терапии гипометилирующими агентами. Предварительные данные, представленные Боратом и его коллегами, показали, что MBG453 плюс децитабин продемонстрировали обнадеживающую предварительную эффективность в этих популяциях пациентов с общей частотой ответа при МДС высокого риска 58%, включая 47% CR/mCR, при этом респонденты продолжали исследование до 2 лет.14 В настоящее время проводится многоцентровое рандомизированное исследование II фазы MBG453 или плацебо в сочетании с гипометилирующими агентами (азацитидин или децитабин) у взрослых пациентов с МДС промежуточного, высокого или очень высокого риска (NCT03946670) и без предшествующей терапии гипометилирующими агентами.Потенциальные механизмы действия MBG453 включают нарушение опосредованного Tim-3-галектин-9 аутокринного самообновления LSC, стимуляцию антителозависимого клеточного фагоцитоза (ADCP) и/или стимуляцию фенотипа M1 в макрофагах (рис. 3).
Предварительные данные, представленные Боратом и его коллегами, показали, что MBG453 плюс децитабин продемонстрировали обнадеживающую предварительную эффективность в этих популяциях пациентов с общей частотой ответа при МДС высокого риска 58%, включая 47% CR/mCR, при этом респонденты продолжали исследование до 2 лет.14 В настоящее время проводится многоцентровое рандомизированное исследование II фазы MBG453 или плацебо в сочетании с гипометилирующими агентами (азацитидин или децитабин) у взрослых пациентов с МДС промежуточного, высокого или очень высокого риска (NCT03946670) и без предшествующей терапии гипометилирующими агентами.Потенциальные механизмы действия MBG453 включают нарушение опосредованного Tim-3-галектин-9 аутокринного самообновления LSC, стимуляцию антителозависимого клеточного фагоцитоза (ADCP) и/или стимуляцию фенотипа M1 в макрофагах (рис. 3).
Клинические антитела против TIM-3: изотип
У человека существует четыре изотипа IgG (IgG1-4), отличающиеся профилями связывания с различными рецепторами Fcγ (FcγR) и субъединицами комплемента, такими как C1q. IgG1 обладает самым высоким сродством ко всем FcγR и C1q, что приводит к значительным эффекторным функциям, таким как ADCC, ADCP и CDC, тогда как IgG2 и IgG4 вызывают значительно более слабую ADCC и CDC или вообще не вызывают их.Большинство анти-TIM-3-антител на ранних стадиях клинической разработки не содержат Fc-рецепторов, за исключением Sym023, представляющего собой IgG1-антитело дикого типа, которое в настоящее время проходит испытания на поздних стадиях солидных опухолей и лимфомы (NCT03489343)96. -TIM-3 mAb (таблица 1) относятся к изотипу hIgG4 со стабилизацией шарнира (S228P) для исключения замены fab-плеч. Недавние данные показали, что антитела hIgG4 с мутацией S228P могут связывать FcγRI и опосредовать ADCP.97, 98 Остается выяснить, действительно ли клинические антитела против TIM-3 опосредуют ADCP, и может ли это быть полезным в условиях ОМЛ/МДС, где TIM Экспрессия -3 на LSC или бластах может приводить к прямой противоопухолевой активности (рис. 3).Следует отметить, что суррогатное mAb против TIM-3, которое продемонстрировало активность в предотвращении лейкемического приживления трансплантата у иммунодефицитной мыши-хозяина, было компетентным как в отношении ADCC, так и в отношении CDC92, что позволяет предположить, что оптимизация вовлечения FcR может быть желательным свойством для анти- mAb TIM-3 при ОМЛ/МДС.
IgG1 обладает самым высоким сродством ко всем FcγR и C1q, что приводит к значительным эффекторным функциям, таким как ADCC, ADCP и CDC, тогда как IgG2 и IgG4 вызывают значительно более слабую ADCC и CDC или вообще не вызывают их.Большинство анти-TIM-3-антител на ранних стадиях клинической разработки не содержат Fc-рецепторов, за исключением Sym023, представляющего собой IgG1-антитело дикого типа, которое в настоящее время проходит испытания на поздних стадиях солидных опухолей и лимфомы (NCT03489343)96. -TIM-3 mAb (таблица 1) относятся к изотипу hIgG4 со стабилизацией шарнира (S228P) для исключения замены fab-плеч. Недавние данные показали, что антитела hIgG4 с мутацией S228P могут связывать FcγRI и опосредовать ADCP.97, 98 Остается выяснить, действительно ли клинические антитела против TIM-3 опосредуют ADCP, и может ли это быть полезным в условиях ОМЛ/МДС, где TIM Экспрессия -3 на LSC или бластах может приводить к прямой противоопухолевой активности (рис. 3).Следует отметить, что суррогатное mAb против TIM-3, которое продемонстрировало активность в предотвращении лейкемического приживления трансплантата у иммунодефицитной мыши-хозяина, было компетентным как в отношении ADCC, так и в отношении CDC92, что позволяет предположить, что оптимизация вовлечения FcR может быть желательным свойством для анти- mAb TIM-3 при ОМЛ/МДС.
Заключение и перспектива
Учитывая, что Tim-3 экспрессируется широким спектром иммунных клеток, а также LSC и активируется несколькими различными лигандами, многое еще предстоит узнать о молекулярных и клеточных схемах, с помощью которых работает Tim-3. опосредовать его биологические эффекты в TME.Несмотря на первоначальные противоречивые наблюдения, предполагающие, что Tim-3 может функционировать как костимуляторный рецептор, недавние сообщения, демонстрирующие, что мутации зародышевой линии с потерей функции в HAVCR2 приводят к заболеваниям, возникающим в результате гиперактивации иммунной системы, делают Tim-3 ингибиторным рецептором. . В настоящее время терапевтический потенциал антител против Tim-3 исследуется при различных типах рака, при этом активность в сочетании с гипометилирующими агентами при ОМЛ/МДС позволяет предположить, что их роль в отношении ЛСК может быть критической, в дополнение к их роли в иммунной регуляции. .Дальнейшее выяснение этих ключевых функций TIM-3 поможет направить клиническую разработку.
Генетика МДС | Кровь
до начала 2000-х годов, только горсть генов, таких как NRAS , 27 TP53 , 27 , 28 RUNX1 , 29 и ATRX , 30 было известно, что было известно, что его МДС. С тех пор, помогая SNP Array кариотипированию и высокопроизводительной капиллярной секвенировке, ряд дополнительных мутационных целей, включая NPM1 , TET2 , CBL , EZH3 , FLT3 , KRAS , MPL , ASXL1 , PTPN11 , KRAS и KIT , были идентифицированы в МДС до 2010 года. 24-26,31-34 Однако в течение следующего десятилетия наши знания о геномах МДС были полностью пересмотрены благодаря всестороннему обнаружению соматических мутаций при МДС и родственных миелоидных новообразованиях 35-38 на основе передовых технологий секвенирования. 39,40
Включая как драйверные, так и недрайверные («пассажирские») мутации, пациенты с МДС несут в среднем 9 соматических мутаций в кодирующей последовательности 36,38,41,42 или ~1500 мутаций во всем геноме (Yasuhito Nannya and the MDS Whole Genome Project, неопубликованное наблюдение), что значительно ниже показателей, обычно наблюдаемых при солидных опухолях.Количество мутаций варьируется в зависимости от подтипа заболевания: 6 на экзом при МДС низкого риска, 9 при МДС с избытком бластов (МДС-ЭБ), 12 при хроническом миеломоноцитарном лейкозе (ХММЛ), 8 неклассифицированных МДС/миелопролиферативных новообразованиях (МПН) и 13 при вторичном ОМЛ (sAML). 36 К настоящему времени идентифицировано >30 генов-драйверов, участвующих в патогенезе МДС (рис. 1А). 35,37 В то время как типичный пациент с МДС имеет в среднем 2 или 3 драйверные мутации, МДС высокого риска (МДС-ЭБ и МДС с многолинейной дисплазией) и ХММЛ, как правило, демонстрируют большее количество драйверных мутаций, чем МДС с более низким риском, включая МДС с однолинейной дисплазией с увеличением количества сидеробластов (RS) или без него и МДС с изолированной del(5q).Драйверные гены-мишени подразделяются на несколько дискретных функциональных путей, включая сплайсинг РНК, метилирование ДНК, транскрипцию, модификацию хроматина, передачу сигнала, репарацию ДНК и другие пути и молекулы (таблица 1). 35,37 В сочетании с CNA и хромосомными аномалиями >78–90% пациентов с МДС имели ≥1 известных рецидивирующих генетических аномалий. 35,37 Среди них наиболее часто наблюдаются те, которые влияют на эпигенетическую регуляцию и сплайсинг РНК, включая метилирование ДНК ( TET2 , DNMT3A и IDh2/IDh3 ) 24,33,43 хромат/гистон Модификация ( mll2 , EZH3 , EZH3 и другие компоненты Polycomb Repressive Compents 2 (PRC2), ARID2 и ASXL1 ), 25 44 , а также сращивание РНК ( SF3B1 , SRSF2 , U2AF1 , U2AF2 , ZXRSR2 , SF1 и SF3A1 ). 41,42,45 Другие часто поражаемые пути или молекулы включают p53, когезин и ассоциированные белки (STAG2, RAD21, SMC1A, SMC3, NIPBL, PDS5b и CTCF), 46 факторы транскрипции (RUNX1, ETV6, GATA32 и IRF1), путь RAS (NRAS, KRAS, PTPN11, NF1 и CBL), 26 другие сигнальные молекулы (JAK2, KIT, MPL, GNB1 и FLT3) и несколько компонентов механизма репарации ДНК (BRCC3, FANCL и банкомат). 35,37 Мутационные мишени во многом сходны при МДС и первичном ОМЛ (рис. 1А), что свидетельствует об общем патогенезе различных миелоидных новообразований.Однако частоты этих мутаций значительно различаются между МДС и первичным ОМЛ; существует чрезмерная представленность мутаций в рецепторной тирозинкиназе ( FLT3 и KIT ) и генах пути RAS, а также мутаций CEBPA и IDh2/IDh3 при ОМЛ, в то время как мутации в факторах сплайсинга (SF) и эпигенетических регуляторы, а также CNA, более распространены при МДС (рис. 1В). Мутации в нескольких генах, таких как DDX41 , RUNX1 , GATA2 и TP53 , могут присутствовать в зародышевой линии и отвечать за предрасположенность к ОМЛ и МДС (таблица 1).Это поднимает сложный вопрос о том, как отличить патогенные варианты от непатогенных полиморфизмов для правильной диагностики семейных случаев, которые будут обсуждаться в другой статье этой серии обзоров.
Когда затрагиваются несколько драйверных генов, их комбинация не является полностью случайной, но некоторые комбинации драйверных мутаций встречаются чаще, чем ожидалось, в то время как другие наблюдаются взаимоисключающим образом, что предполагает наличие функциональных взаимодействий между этими мутациями, которые участвуют в положительном и отрицательном отборе (рис. 2).Например, мутации SF почти исключают друг друга, как и мутации в компонентах комплекса cohesin, вероятно, из-за синтетической летальности множественных мутаций в этих путях и комплексах. Напротив, мутации STAG2 в значительной степени связаны с мутациями в RUNX1 , SRSF2 , ASXL1 , EZh3 , BCOR и ID4223 9. Как видно из небольшого количества значимых корреляций в левом нижнем прямоугольнике на рисунке 2, положительные и отрицательные корреляции, как правило, разделяются по генным мутациям и хромосомным CNA.Основными исключениями являются значительные положительные корреляции, наблюдаемые между мутациями TP53 и CK, а также между приростом 1p, +8, 11p LOH, 11q LOH, 17p LOH и +21 и соответствующими мутациями (рис. 2).
.

 08.2020 № 421/пр) если ее передача застройщику, заказчику (техническому заказчику) осуществляется, начиная с 5 октября 2020 года. При этом в организации по проведению государственной экспертизы должен представляться документ, подтверждающий передачу проектной документации (в том числе раздела «Смета») застройщику, заказчику (техническому заказчику).
08.2020 № 421/пр) если ее передача застройщику, заказчику (техническому заказчику) осуществляется, начиная с 5 октября 2020 года. При этом в организации по проведению государственной экспертизы должен представляться документ, подтверждающий передачу проектной документации (в том числе раздела «Смета») застройщику, заказчику (техническому заказчику).