Железный или медный купорос что лучше: Применение медного и железного купороса в огороде
Железный и медный купорос. — Энциклопедия роз
Железный и медный купорос.Различия между медным и железным купоросом
Железный купорос, в отличие от медного, имеет вид мелкокристаллического порошка. Он обладает универсальными свойствами, способными не только вести борьбу с грибными заболеваниями, но и улучшать плодоношение старых плодовых деревьев. Железный купорос необходим в случае хлороза, когда у растений наблюдается недостаток железа. Его применяют для дезинфекции ран и дупел, в качестве составляющей в побелке стволов для защиты от болезней. Пятипроцентный раствор железного купороса используют против парши и септориоза, а 3% – от черной пятнистости.
Одной из распространенных ошибок является добавление железного купороса в раствор извести. Известь можно добавлять в медный купорос, но не в сульфат железа.
Необходимо помнить! Железный купорос не применяется для уничтожения клещей, грызунов и в качестве стимулятора роста.
Медный купорос, в отличие от железного, может применяться для подкормки в случае недостатка меди в составе почвы, но большее распространение он получил в качестве фунгицида – средства для борьбы с грибными заболеваниями. И по сегодняшний день не найдено более эффективных методов борьбы с различными гнилями и грибными инфекциями, чем медный купорос и препараты с его содержанием.
Медный купорос в садоводстве
Медный купорос (или сульфат меди) – это соль, образованная в результате взаимодействия меди с серной кислотой, одно из наиболее проверенных временем средств, эффективность которого садоводы сумели оценить много лет назад и до сих пор не разочаровались в его действии.
Используется как в чистом виде, так и входящим в состав различных медьсодержащих препаратов («Купронафт», бордоская и бургундская жидкость, «Хлорокись меди», «Медекс» и другие). Он выглядит как кристаллы красивого голубого цвета, теряющие свой цвет при контакте с воздухом. Обладает антисептическими и вяжущими свойствами, при нагревании способен образовывать опасные для человека газы. Благодаря своему подавляющему действию на развитие грибных очагов, успешно применяется в домостроении для обработки древесины от плесени и защиты от гниения. Незаменим медный купорос в садоводстве для дезинфекции ран на стволах деревьев и для борьбы с болезнями растений.
Благодаря своему подавляющему действию на развитие грибных очагов, успешно применяется в домостроении для обработки древесины от плесени и защиты от гниения. Незаменим медный купорос в садоводстве для дезинфекции ран на стволах деревьев и для борьбы с болезнями растений.
Использование сульфата меди
Препараты на основе медного купороса часто применяют в качестве эффективного средства для подавления различных заболеваний растений, им обрабатывают деревья, ягодные и декоративные кустарники от монилиоза, пятнистостей, антракноза, различных гнилей, парши и от множества подобных болезней, вызванных распространением возбудителей грибковых инфекций.
В профилактических целях не рекомендуется постоянно выращивать растения, подверженные риску поражения грибными инфекциями, на одном и том же месте, чтобы не подвергать земельные участки многократной обработке препаратами с содержанием медного купороса и не способствовать накоплению его в почве. К многолетним растениям, подолгу выращиваемым на одном месте, рекомендуется применять чередование опрыскиваний медным купоросом с препаратами, содержащими железо. Например, осенью опрыскать растения железным купоросом, а весной и летом – с содержанием меди.
Например, осенью опрыскать растения железным купоросом, а весной и летом – с содержанием меди.
Тара для размешивания и хранения должна быть либо пластиковой, либо стеклянной. При работе с медным купоросом нельзя использовать металлическую тару.
Выше мы уже упоминали, при каких заболеваниях необходимо использовать медный купорос. Применение в садоводстве этого контактного фунгицида широко распространено.
Чаще всего купорос используется рано весной, пока почки закрыты, либо поздней осенью, после листопада. Необходимая концентрация: на десять литров воды сто грамм растворенного медного купороса.
Обработка медным купоросом во время вегетации растений возможна в составе бордоской жидкости либо других медьсодержащих фунгицидов. Чистый же раствор медного купороса может повредить листья, поэтому летом обрабатывать им деревья и кустарники не стоит.
Применение рабочего раствора для подавления грибковых заболеваний не должно превышать 2 литров на одно молодое растение (до шести лет), на более взрослое плодоносящее дерево – не больше десяти литров и до полутора литров на ягодный куст. Раствор не хранят и готовят непосредственно перед применением, для этого медный купорос растворяют в небольшом количестве воды и лишь затем доводят до рекомендуемой концентрации, доливая воду.
Раствор не хранят и готовят непосредственно перед применением, для этого медный купорос растворяют в небольшом количестве воды и лишь затем доводят до рекомендуемой концентрации, доливая воду.
Опрыскивают растения в безветренную погоду, ранним утром или вечером, чтобы не допустить попадание раствора на пчел и полезных насекомых. Рекомендуется проводить обработку не меньше чем за четыре часа до предполагаемого дождя. Использовать медный купорос для защиты от заболеваний целесообразно в период, когда болезнь еще не распространилась на все растение, а также в профилактических целях.
Применение медного купороса
Применяют для следующих целей:
-в качестве антисептика для обработки ран на стволах плодовых деревьев;
-для дезинфекции корней саженцев (например, роз) перед посадкой;
-для дезинфекции овощных хранилищ, погребов и деревянных построек с целью предупреждения развития плесени и разрушения древесины.
-для дезинфекции семенного материала перед посевом;
-для обработки семенного картофеля перед посадкой.
-для дезинфекции овощных хранилищ, погребов и деревянных построек с целью предупреждения развития плесени и разрушения древесины.
-против парши яблони;
-от коккомикоза косточковых;
-против курчавости персика;
-от антракноза и септориоза крыжовника и смородины;
-от некоторых пятнистостей и мучнистых рос;
-против клястероспориоза.
Примечание: Во время обсуждения на форуме Ложная мучнистая роса — ищем эффективный путь борьбы и Сорта, устойчивые к ЛМР + диагностика заболевания. Страница 2-ая, коллективный разум пришел к выводу, что медный купорос и бордосская жидкость являются профилактическим средством против ЛМР, а не лечебным.
Медный купорос в качестве удобрения
В регионах, где в почве не хватает меди, используется как удобрение. Особенно необходимо использование меди в районах бывших торфяников или на некоторых песчаных почвах, где медь в земле находится в недостаточных количествах. Можно по некоторым признакам определить недостаток меди в почве, так как у растений, произрастающих на ней, происходит съеживание листьев, появляются признаки хлороза и некротические пятна. Помочь могут внекорневые подкормки 0,01-0,02% раствором медного купороса (1-2 грамма сульфата меди на ведро воды). Опрыскивание лучше проводить в тихую погоду без ветра.
Помочь могут внекорневые подкормки 0,01-0,02% раствором медного купороса (1-2 грамма сульфата меди на ведро воды). Опрыскивание лучше проводить в тихую погоду без ветра.
Приготовление бордоской жидкости
Для приготовления состава необходимо сто грамм медного купороса, сто грамм извести и десять литров воды. В ведре разводится медный купорос в пяти литрах воды, отдельно гасят известь в небольшом количестве воды, добавляют воду до пяти литров, процеживают. Оба состава соединяют при постоянном помешивании. Полученный раствор должен быть небесно-голубого цвета.
Меры предосторожности
Можно считать применение медного купороса умеренно вредным для человека. Он, конечно, токсичен и при попадании большой дозы в организм может вызвать отравления. Минимальная доза, являющейся смертельной для человека, составляет 11 мг на килограмм веса, но это исключительная ситуация и получить подобное количество медного купороса случайно, вдыхая его во время опрыскивания растений, невозможно.
Глаза и слизистые оболочки во время обработки лучше поберечь, а при случайном попадании купороса их следует немедленно промыть водой. Проводить опрыскивание лучше в респираторе или маске, а после работы принять душ или хотя бы вымыть с мылом лицо и руки.
Важно! Вариантов для использования медного купороса в садоводстве довольно много, но для получения максимального эффекта и соблюдения биологического баланса в развитии растений, необходимо соответствовать инструкции в приготовлении смеси и строго соблюдать ее дозировку.
Железный купорос: характеристика и использование
Железный купорос выпускается в виде кристаллического порошка голубого цвета с зеленоватым оттенком. Раствор железного купороса – часто используемое средство, которое применяют на дачных участках.
Имеет неограниченный срок использования при правильном хранении.
Борьба с болезнями растений
Железный купорос в садоводстве – очень доступное, прошедшее испытание годами и недорогое средство. Поэтому рассмотрим подробнее применение железного купороса в садоводстве.
Поэтому рассмотрим подробнее применение железного купороса в садоводстве.
Железный купорос полезен в таких случаях:
-обработка стен подвала и овощехранилища;
-залечивает срезы, дупла, раны на садовых деревьях;
-весенняя и осенняя побелка стволов плодовых деревьев;
-борьба с лишайниками;
-используют в качестве удобрения;
-средство дезинфекции выгребной ямы, дачного туалета.
Болезни, от которых эффективно защитит обработка сульфатом железа:
-настоящие мучнистые росы;
-ложные мучнистые росы;
-клястероспориоз;
-коккомикоз;
-антракноз;
-серая гниль.
Обработку растений железным купоросом проводят ранней весной, до распускания почек или же осенью, после листопада. Опрыскивают не только само растение, но и почву вокруг него. На зеленые листья железный купорос не должен попасть, иначе возможны ожоги на них. Для обработки деревьев и кустарников применяется 3-5% раствор. Для приготовления рабочей смеси нужно растворить 300 или 500 грамм железного купороса в 10 литрах воды. Кустарники и молодые деревья предпочтительнее обрабатывать трехпроцентным раствором, для взрослых деревьев или для старого запущенного сада используется пятипроцентный состав. Избавиться от лишайников и мхов на коре деревьев поможет обработка в начале весны раствором 6% концентрации.
Кустарники и молодые деревья предпочтительнее обрабатывать трехпроцентным раствором, для взрослых деревьев или для старого запущенного сада используется пятипроцентный состав. Избавиться от лишайников и мхов на коре деревьев поможет обработка в начале весны раствором 6% концентрации.
Обратите внимание! Обработку проводят в безветренную, пасмурную и сухую погоду.
Применение железного купороса для дезинфекции
Отличное средство для обработки стен погреба – это раствор железного купороса. Средство отличается дешевизной и своим не сильным токсическим свойством. Раствор готовят, используя 10% концентрацию. На стены рабочую жидкость наносят кистью, для улучшения эффекта можно добавить глину, до образования сметанообразной консистенции. Эта обработка помогает бороться с грибками и насекомыми. Процедуру повторяют два раза осенью до того, как помещают овощи на хранение, после хорошо проветривают погреб.
Для устранения запаха с выгребных ям используют такой состав: 250 г на 5 л воды. Его также используют при появлении грибка в домах, для обработки стен, концентрация раствора: 150 г на 1 л воды.
Его также используют при появлении грибка в домах, для обработки стен, концентрация раствора: 150 г на 1 л воды.
Дезинфекцию теплиц проводят с помощью раствора в концентрации 150 г на 1 л воды, опрыскивают или промазывают кистью все деревянные части теплицы.
Для обработки ран на плодово-ягодных деревьях нужно смешать 100 г купороса с 1 литром воды и кисточкой тщательно пройти все поврежденные места.
Инструкция по применению железного купороса для обработки садовых деревьев
Раствор железного купороса имеет высокую кислотность и при попадании на зеленый лист вызывает ожоги. Поэтому обработку деревьев железным купоросом проводят весной – до распускания листьев и осенью — после опадения.
И весной, и осенью основным очагом грибной инфекции являются растительные остатки на поверхности почвы и отчасти в самой почте. Поэтому при опрыскивании садовых деревьев медным купоросом весной необходимо также опрыскать и поверхность земли вокруг них. Осенью, в принципе, тоже, но эффективнее будет убрать и сжечь опавшие листья, а приствольные круги — окопать. После этого можно дополнительно провести обработку деревьев железным купоросом: это позволит подавить инфекцию, которая сохраняется на самих деревьях.
После этого можно дополнительно провести обработку деревьев железным купоросом: это позволит подавить инфекцию, которая сохраняется на самих деревьях.
Инструкция по применению: концентрация и нормы расхода железного купороса
-Концентрация для борьбы с лишайниками – 4…6%;
-концентрация для защиты от грибных заболеваний – 3…4% (старые учебники по хим. защите рекомендуют 5…8%).
-норма расхода рабочей смеси при опрыскивании садовых деревьев – 10…15 литров на 100 м2
-норма расхода рабочей смеси при опрыскивании винограда – 10 литров на 100 м2
Опрыскивание деревьев железным купоросом рекомендуется проводить в пасмурную, безветренную погоду. Следует учитывать, что первый же сильный дождь самое большую часть препарата с деревьев и поверхности почвы. Поэтому, планируя обработку, следует принять во внимание прогноз погоды.
Сульфат железа в качестве удобрения
Порошок железного купороса – это не только средство для борьбы с болезнями, но и отличное удобрение. При недостатке железа у многих растений наблюдается раннее пожелтение листьев, гибель побегов, листья становятся блеклыми, не такими зелеными. Без него нормальное существование культур невозможно, у растений развивается хлороз. В качестве удобрения раствор порошка используют в садоводстве для внекорневой подкормки картофеля, помидоров, всех видов капусты и других культур. Для этого в емкости растворяют 5-10 грамм порошка, заливая 10 литрами воды. Воду для раствора нужно брать мягкую и не смешивать с известью.
При недостатке железа у многих растений наблюдается раннее пожелтение листьев, гибель побегов, листья становятся блеклыми, не такими зелеными. Без него нормальное существование культур невозможно, у растений развивается хлороз. В качестве удобрения раствор порошка используют в садоводстве для внекорневой подкормки картофеля, помидоров, всех видов капусты и других культур. Для этого в емкости растворяют 5-10 грамм порошка, заливая 10 литрами воды. Воду для раствора нужно брать мягкую и не смешивать с известью.
Садоводы с большим стажем научились готовить хелат железа, для его получения необходимо в ведре объемом 10 литров развести две чайные ложки лимонной кислоты, после полного растворения в воде в полученный раствор кладут одну столовую ложку сульфата железа. Этим составом поливают растение под корень при хлорозе.
Меры предосторожности
Сернокислое железо – не такое токсичное вещество, как сульфат меди. Но работая с ним, нужно тоже придерживаться определенных правил. При попадании вещества на кожу необходимо тщательно промыть большим количеством воды как можно быстрее. При жжении обратиться к врачу. Избегать также попадания раствора или вещества в глаза и на слизистые оболочки. Обязательно используйте защитную одежду, перчатки, после работы с раствором нужно тщательно вымыть руки и лицо.
При попадании вещества на кожу необходимо тщательно промыть большим количеством воды как можно быстрее. При жжении обратиться к врачу. Избегать также попадания раствора или вещества в глаза и на слизистые оболочки. Обязательно используйте защитную одежду, перчатки, после работы с раствором нужно тщательно вымыть руки и лицо.
Железный и медный купорос: когда применять и как развести | Антонов сад — дача и огород
Медный и железный купорос давно и прочно вошли в обиход дачников и эффективно используются в качестве фунгицидных препаратов. Железный купорос нетоксичен, восполняет нехватку железа в почве. С медным купоросом надо быть осторожнее, он входит в состав популярной в садоводстве бордоской жидкости, для защиты растений можно использовать только весной. Рассказываем, как правильно использовать их на участке, в каких пропорциях и в чем разница между ними.
Применение железного купоросаЖелезный купорос — голубовато-зеленые кристаллики, содержащие до 55% активного вещества. Токсичных компонентов железный купорос не содержит, но передозировка бывает опасна.
Токсичных компонентов железный купорос не содержит, но передозировка бывает опасна.
Подкормка железным купоросом
- Железным купоросом можно удобрять почву, обогащая ее железом, смешивая, например, с органическими подкормками.
- Но нужно быть уверенным, что железа в почве на вашем участке мало. В противном случае в качестве удобрения железный купорос лучше не использовать.
- Железный купорос помогает избавиться и от ряда вредителей. Обработка раствором 5%-го железного купороса истребит и насекомых, и личинки, и яйцеклад.
- Не устоят перед железным купоросом и болезни: черный рак, серая гниль, парша, мучнистая роса и др.
- Для дезинфекции срезов и ран на плодовых деревьях приготовьте раствор из 100 г железного купороса и 1 л воды и обработайте повреждения.
В побелку железный купорос добавлять опасно: реакция с известью может быть непредсказуемой
Как развести железный купоросПроцентные дозировки применения:
— при массовой осенней и весенней профилактической обработке – 5% (для этого развести 500 г железного купороса в 10 л воды)
— для борьбы с болезнями в стадии вегетации – не более 1%, лучше – 0,3–0,5% (развести 100 г и менее в ведре воды)
Фото: кристаллы железного купоросаФото: кристаллы железного купороса
Применение медного купоросаАктивного элемента в медном купоросе всего четверть, все остальное – это примеси. Внешне это голубовато-синие гранулы.
Внешне это голубовато-синие гранулы.
Медный купорос считается ядовитым средством, и при использовании нужно применять индивидуальные средства защиты
Медный купорос от болезней и вредителей- Медный купорос, в отличие от железного, используют для профилактики болезней и перезимовавших вредителей лишь весной.
- В течение сезона из-за токсичности его стараются не применять.
- Часто с помощью медного купороса борются с различными гнилями.
Ни в коем случае медный купорос нельзя сочетать с иными пестицидами!
Медный купорос для подкормки- Осенью медный купорос применяют для подкормки растений.
- В качестве удобрения его используют обычно для травы, на которой пасутся и питаются сельскохозяйственные животные, – она начинает расти быстрее и гуще.
С медным купоросом готовят много составов: например, бордоскую жидкость и др.
— для обработки весной плодовых деревьев можно использовать максимум 1%-й раствор препарата (100 г на 10 л воды),
— для весенней обработки кустов крыжовника и смородины хватит 0,5%-го раствора (50 г на 10 л воды). На других ягодных кустарниках медный купорос применять нежелательно!
На других ягодных кустарниках медный купорос применять нежелательно!
— для дезинфекции корней саженцев при высадке: окунуть их на пару минут в 1%-й раствор (100 г на 10 л воды).
— при борьбе с болезнями можно использовать весеннее опрыскивание 0,5%-м раствором медного купороса (50 г на 10 л воды).
Фото: кристаллы медного купоросаФото: кристаллы медного купороса
Как приготовить 1% раствор бордоской жидкости
Для приготовления бордоской жидкости медный купорос разводят в воде на пару с известью.
Понадобится: 100 г медного купороса, 100-150 г негашеной извести, 10 л воды.
- Медный купорос тщательно растворите в 1 л подогретой до 50 °С воды, объем доведите холодной водой до 5 л.
- Негашеную известь растворите в небольшом количестве холодной воды. После гашения добавьте еще воды и доведите объем до 5 л, хорошо перемешайте.
- Затем тонкой струйкой влейте раствор медного купороса в приготовленную известковую суспензию, одновременно помешивая.

Для приготовления 3% раствора бордоской жидкости используют по 300 г гашеной извести и медного купороса на 10 л воды.
Еще больше статей читайте на нашем сайте «Антонов Сад.ру»
А так-же в нашей группе В контакте.
ЖЕЛЕЗНЫЙ И МЕДНЫЙ КУПОРОС ДЛЯ САДА
ЖЕЛЕЗНЫЙ И МЕДНЫЙ КУПОРОС ДЛЯ САДА
Сульфат железа (железный купорос) является удобрением для растений и служит для их питания.
Использование железного купороса:
— Железный купорос помогает бороться при мучнистой росе, плодовой гнили,парше, черной пятнистости;
— Питает растения;
— Железный купорос помогает бороться с хлорозом.
— С помощью железного купороса можно победить мох и лишайники на плодовых деревьях;
— Железный купорос лечит от засоления почвы;
— Железным купоросом можно белить подвалы и окрашивать древесину, для консервирования дерева.
Хороший, качественный железный купорос имеет вид светло-зелёных кристаллов, которые при хранении на воздухе желтеют и портятся.
Во избежание этого хранить железный купорос нужно в хорошо закупоренной посуде, в сухом помещении.
Опрыскивают железным купоросом деревья и кустарники в период покоя, когда они находятся в безлиственном состоянии. Железный купорос убивает мхи, лишайники и яички медяницы и тлей.
Приготовление раствора железного купороса:
Для опрыскивания составляют раствор крепостью 8% или чаще 5%, т.е. на 100 литров воды берут 5-8 кг. кристаллов железного купороса. Раствор надо готовить обязательно в пластиковой, а не металлической посуде.
ОБРАБОТКА ДЕРЕВЬЕВ ЖЕЛЕЗНЫМ КУПОРОСОМ
После обработки до лета мох и лишайники исчезнут, дерево станет здоровее и живее. Что касается урожая, то он порадует вас уже на следующий год.
Если в вашем саду старые деревья, то опрыскивать их железным купоросом следует так же и осенью. Это позволит подготовить деревья к холодам и в целом закрепить результат.
Одной из ошибок является добавление в железный купорос извести. На самом деле известь добавляется, но только в медный купорос.
На самом деле известь добавляется, но только в медный купорос.
Смесь медного купороса и извести используются при приготовлении бордосской жидкости из-за чего и может происходить путаница. В основном эта ошибка допускается неопытными садоводами, что оказывает негативное влияние на все деревья в саду.
Чтобы применять железный купорос правильно стоит учитывать и характер заболевания каждого дерева в отдельности. Так если ваши деревья болеют яблонной медяницей, то 5-7% раствор не годится.Необходимо использовать 3% раствор.
Стоит учитывать и тот факт, что раствор нужно использовать до того момента, как набухнут почки, чтобы не нанести никакого вреда будущим плодам.
Нужно понимать, что опрыскивая железным купоросом деревья ,избавить их от вредителей на 100% не удастся. Чтобы полностью побороть ту или иную болезнь необходимо будет использовать и специальные средства. К таковым относится раствор табака-махорки. Но все же если опять вспомнить о яблонной медянице, то от нее избавиться достаточно трудно и в течение одного года сделать это скорей всего не удастся.
Однако если с помощью железного купороса вы избавитесь от этого насекомого хотя бы на 50%, это уже будет очень хорошо для ваших деревьев. Обрабатывать деревья рассматриваемым средством стоит в период между 10-ми и 20-ми числами апреля.
Если вы выполните опрыскивание раньше, то попросту не будет никакого эффекта, потому что насекомое еще не проснется после зимы. Если это сделать позже, то может быть нанесен вред, как самому дереву, так и будущему урожаю.
ЖЕЛЕЗНЫЙ КУПОРОС – УДОБРЕНИЯ ДЛЯ САДА И ОГОРОДА
В рамках данной статьи хотелось бы упомянуть и о том, что железный купорос может использоваться не только в качестве инсектицида и фунгицида, но также как удобрение, доставляя растениям железо в легкодоступной форме.
Как известно недостаток железа в почве негативно сказывается на нормальном развитии и росте растений. О том, что растения испытывают недостаток железа можно судить по желтеющей и опадающей листве. Кроме этого побеги отмирают, плоды развиваются плохо.
Для огородных культур, таких как капуста, картофель, а также томаты железный купорос может быть использован как удобрение. Для приготовления раствора разводят до 10 г порошка в 10 л воды и выполняют внекорневые подкормки растений путем опрыскивания.
На самом деле сфера применения железного купороса достаточно широкая. Его также можно использоваться для побелки стен погребов, для борьбы с домовым грибком стен.
Каждый год нужно смотреть на то, как пробуждается природа. Если зима была затянувшаяся, то опрыскивать деревья можно в конце апреля.
В том случае если весна ранняя и на деревьях уже начинают распускаться почки, то лечением сада заняться самое время. Это говорит о том, что время обработки зависит как от конкретного года, сложившихся погодных условий, так и в целом от региона, где вы проживаете.
Железный купорос позволяет не только бороться с лишайниками и мхами, но также увеличивает запас плодовых почек и прирост ветвей. Это благоприятно отражается как на увеличении урожая, так и на красоте вашего сада.
Как можно судить из всего вышеописанного обработка железным купоросом является универсальным и доступным способом, который поможет вашим садовым деревьям независимо от их заболеваний.
Медный купорос (синий камень)
В виде раствора медный купорос употребляют в качестве дезинфицирующего средства.
Дезинфицируют медным купоросом корневую систему саженцев с признаками ракового заболевания, а также раны и дупла деревьев.
Для этих целей раствор готовят из расчета 1 кг медного купороса на 100 л воды. Растворять медный купорос нужно в теплой воде и обязательно в пластиковой, но не в металлической посуде.
Для опрыскивания деревьев и кустов медный купорос используется только в качестве составной части бордосской жидкости.
Как известно данное средство используется в качестве фунгицида для огородных и садовых растений. Поэтому рассмотрим, что собой собственно представляет данная жидкость, из каких компонентов состоит и как ее приготовить своими руками.
Как приготовить бордосскую жидкость – важные моменты
Основой бордосской жидкостью является смесь извести и медного купороса, а если быть точным, то водных растворов известкового молока и медного купороса (не путаем с железным купоросом,который также используется для обработки садовых насаждений).
Одним из важных моментов в процессе приготовления рассматриваемого раствора является то, что среда, в которой будет происходить взаимодействие медного купороса и щелочи, должна быть щелочной. Это позволяет получить очень мелкие частицы сернокислой меди, благодаря которым и происходит борьба с бактериями и грибками.
В результате эти частицы отлично держатся на поверхности растений в течение длительного времени.
Если раствор бордосской жидкости будет приготовлен правильно, то осадок голубого цвета должен оставаться во взвешенном состоянии довольно продолжительное время. Собственно рецептура и состав для приготовления 1% раствора бордосской жидкости таковы (из расчета получения 10 литров раствора):
медный купорос 100 гр;
негашеная известь 100 гр;
вода 8 л
Указанные составляющие нужно разводить в разных емкостях. Для медного купороса можно взять медную, деревянную, стеклянную либо глиняную посуду. Растворяем его в 1 л теплой воды. Известь гасим в другой емкости также в 1 л воды.
Для медного купороса можно взять медную, деревянную, стеклянную либо глиняную посуду. Растворяем его в 1 л теплой воды. Известь гасим в другой емкости также в 1 л воды.
После того как оба раствора будут готовы вливаем раствор медного купороса в известковое молоко. Для помешивания используем деревянную палочку. В процессе объем нужно довести до 10 л. Для этого используют чистую воду и при этом постоянно помешивают.
КАКИЕ МОГУТ ВОЗНИКНУТЬ ТРУДНОСТИ?
Если садовод не обладает достаточным опытом, то в процессе приготовления данного раствора возможны некоторые затруднения.
Чтобы растения не получили ожог нужно проверить реакцию на лакмусовой бумаге. Если бумажка стала синей, в растворе слишком много извести. О чем это говорит? А говорит это о том, что такой раствор характеризуется слабыми фунгицидными свойствами.
Осадок в такой бордосской жидкости будет образовываться достаточно быстро и по поверхности она будет в процессе обработки распределяться неравномерно.
При большом количестве извести раствор будет плохо прилипать к стеблям и листьям. Но лакмусовая бумага может и покраснеть и говорить это будет о переизбытке медного купороса.
Нужно знать, что применять такой раствор для растений нельзя, поскольку он токсичен. У вас может не оказаться лакмусовой бумаги. Не беда.
Проверить раствор можно с помощью обычного гвоздя или даже ножа. В том случае, если на металле появляется красный налет, это говорит об избытке сульфата меди (именно он появляется на металле) и о том, что раствор приготовлен неправильно.
Для понижения кислотности бордосской жидкости добавляется определенное количество известкового молока. Какое именно количество, определяется опытным путем. При правильно приготовленном растворе металл не должен покрываться медью.
КАК ДОЛГО МОЖНО ХРАНИТЬ БОРДОССКУЮ ЖИДКОСТЬ?
Если раствор использовать через несколько дней, то он становится малоэффективным.
С бордосской жидкостью нужно обращаться аккуратно. Используя 1% раствор в период вегетации на листьях, а также плодах могут появляться ожоги. Если говорить о плодах, то выглядит это как коричневая сетка.
Используя 1% раствор в период вегетации на листьях, а также плодах могут появляться ожоги. Если говорить о плодах, то выглядит это как коричневая сетка.
Фитотоксичность препарата усиливается в прохладную, а также дождливую погоду. Также на плодах могут появляться бурые пятна. Ожоги в большей степени опасны для молодых плодов.
Наиболее чувствительными к бордосской жидкости являются такие плодовые деревья как черешня и абрикос.
по материалам журнала «Наша Дача.» http://nashadacha.info/topics/zheleznyj-i-mednyj-kuporos-dlya-sada/
Медный купорос и железный купорос разница. Что эффективнее медный или железный купорос. Для чего применяется медный и железный купорос в садоводстве. Читают прямо сейчас
Медный купорос и железный купорос разница. Что эффективнее медный или железный купорос. Для чего применяется медный и железный купорос в садоводстве. Читают прямо сейчас
Чем отличается медный купорос от железного купороса?
- ссылки не проходят поэтому привожу статью:
Между этими купоросами существует разница и очень даже большая. Во-первых, железо и медь как химические элементы оказывают разное воздействие на вегетационный процесс растений. Во-вторых, состав микроэлементов в медном и железном купоросах тоже не одинаков и применять их следует грамотно и осторожно.
Во-первых, железо и медь как химические элементы оказывают разное воздействие на вегетационный процесс растений. Во-вторых, состав микроэлементов в медном и железном купоросах тоже не одинаков и применять их следует грамотно и осторожно.Вот, к примеру, железо, без которого многие растения просто не могут существовать. Особенно любят железо смородина и крыжовник. Хорошо отзываются ягодники и на полив ржавой водой из бочки, где лежат металлические отходы с содержанием железа.
И все же без железного купороса (сернокислого железа) растениям не обойтись. Дело в том, что синевато-зеленые кристаллы железного купороса — практически единственное доступное концентрированное удобрение, содержащее в своем составе 47-53% микроэлемента железа. Недостаток железа у растений способствует возникновению различных заболеваний и особенно такого опасного, как хлороз. У растений, пораженных хлорозом, приостанавливается рост, отмирают края листьев, иногда бывает преждевременный листопад, плоды мельчают, урожай резко снижается, а в ряде случаев усыхают вершины и все дерево.
Чаще всего недостаток железа восполняется путем опрыскивания растений раствором железного купороса. Внекорневую подкормку можно производить как в период вегетации растений водным раствором купороса (50г на 1л воды) , так и после опадения листьев (300г на 10л воды) . Для борьбы с хлорозом в почву вносят 1-1,5% раствор железного купороса (100-150г на 10л воды) .
Железный купорос — известное средство для уничтожения дурных запахов и дезинфекции выгребных ям и мест содержания скота и птицы.Медный купорос (сульфат меди, сернокислая медь) — кристаллы голубого цвета, содержит 24% меди. К недостатку меди наиболее чувствительны яблони, груши и сливы. Медный купорос применяется прежде всего для подкормки растений на торфяных, песчаных и других почвах, бедных подвижными формами меди.
Подкормки сернокислой медью проводят 3-4 раза за сезон путем опрыскивания растений рабочим раствором из расчета 1 чайная ложка (5г на 10-15л воды) . Осеннее опрыскивание плодовых и декоративных растений (после опадения листьев) или ранне-весеннее опрыскивание до распускания почек проводят 3% рабочим раствором из расчета 30г на 1л воды.

Медный купорос в основном в смеси с известью применяют для опрыскивания плодово-ягодных, декоративных и ягодных кустарников от парши, бурой, белой и дырчатой пятнистостей, коккомикоза и побурения листьев вишни, плодовой и серой гнили, черного, корневого и обыкновенного рака плодовых растений, других заболеваний. Растворы медного купороса применяются также для борьбы с мхами и лишайниками на стволах деревьев. Обработка проводится осенью после листопада путем опрыскивания или обмазывания пораженных деревьев.
Медный купорос и железный купорос разница для гортензий. Железный купорос
Железный купорос или сульфат железа-II — это фунгицид для защиты садовых растений от грибковых болезней, а также уничтожения мхов и лишайников на деревьях. Представляет собой 53% соль образованную при взаимодействии двухвалентного железа и серной кислоты, связанную с молекулами воды (кристалгидрат) — гранулы или порошок светло-зеленого или серо-зеленого цвета (иногда с бурым оттенком), хорошо растворимые в воде.
Механизм действия: контактный. Период защитного действия 14 дней. Срок хранения железного купороса не ограничен, препарат гигроскопичен, поэтому хранить его нужно в плотно закрытой стеклянной или пластиковой таре в сухом месте.
Применение
Железный купорос используется в саду для защиты растений от ряда заболеваний:
- альтернариоза
- антракноза
- коккомикоза
- кластеросопориоза
- серой гнили
- парши яблони и груши
- ложной мучнистой росы
- настоящей мучнистой росы
- оидиума винограда
Сульфат железа не защищает от бактериальных инфекций. Практически не используется в комнатном цветоводстве.
Опрыскивать деревья и кустарники можно только весной или осенью — строго до распускания почек или после листопада и оголения ветвей. Железный купорос не применяется в качестве удобрения и для лечения инфекций по зеленому листу — вызывает ожоги тканей листа — кислотность 3-5% раствора около рН 3-5 (очень кислая реакция).
Нормы расхода
Как правило, применяют следующие концентрации:
- 3% раствор для косточковых культур (сливы, вишни, абрикосы, персики, черешня, алыча) — 300 г порошка железного купороса на 10 л воды. Опрыскивание перед укрытием по голым ветвям или лозе.
- 4-5% раствор для семечковых (яблоня, груша, айва, арония, виноград): 400-500 г порошка железного купороса на 10 л воды, с нормой расхода около 10-15 л на 100 м2.
- 5-6% раствор — для уничтожения мхов и лишайников на деревьях и садовой плитке, а также подвала или погреба от плесени: 500-600 г порошка железного купороса на 10 л воды.
Если у вас нет весов, отмеряйте на глаз 2% раствор: пол столовой ложки железного купороса на 1 литр воды, получиться ярко-оранжевый цвет жидкости.
Железный купорос задерживает распускание почек (примерно на неделю), поэтому обработка 3-4% раствором до начала вегетации, помогает пережить период весенних заморозков. Особенно актуально для таких культур как виноград, если обработать примерно через неделю после снятия зимнего укрытия, исключительно по голой лозе с нераскрытыми почками.
Недостатки железного купороса
- нельзя опрыскивать по листьям и молодым приростам — сульфат железа их сжигает в концентрации более 1%
- концентрация до 1% — практически не эффективна для патогена
- железный купорос быстро окисляется до трехвалентного железа и утрачивает свои фунгицидные свойства
- поэтому период защитного действия в среднем всего 10-14 дней
- очень осторожно нужно обрабатывать весной, желательно использовать только осенью
Эффективность железного купороса
Обработка железным купоросом весной задерживает раскрытие почек, замедляет пробуждение куста, а это, в зависимости от погоды, как плюс, так и минус.
Если же говорить об эффективности сульфата железа как фунгицида, то она довольно сомнительна — поверхностное опрыскивание ветвей не убивает полностью грибок, споры могут сохраняться в закрытых местах (например, за корой) и местах недоступных обработке. Поэтому если у вас ценные сорта винограда или фруктовых деревьев, предпочтение следует отдавать препаратам меди: это медный купорос , бордоская смесь , оксихом и др.
Хотя многие садоводы весьма результативно применяют такую схему обработки сада от болезней: весной — опрыскивание медным купоросом, осенью — железным.
Совместимость железного купороса
Препарат несовместим в общих растворах с фосфорорганическими инсектицидами и другими препаратами, разлагающимися в щелочной среде. Не допускается смешивание сульфата железа с известью.
Токсичность
Железный купорос имеет 3 класс опасности для человека, опасность для пчел не оценивается, так как обработки по листьям и цвету не проводятся. Сульфат меди фитотоксичен в концентрациях более 1% так как сильно кислая реакция раствора съедает тонкий эпидермис, более плотные покровы ветвей и ствола выдерживают концентрацию не более 6%.
Железный купорос и медный купорос в чем разница. Железный купорос и медный купорос — отличия
Главное отличие между этими препаратами в воздействии на культуры. Медным купоросом допускается опрыскивание листвы, а железным купоросом обрабатывают деревья и кустарники только до распускания почек или поздней осенью, никак не по зеленой листве.
Сульфат меди ( голубые гранулы ) является прекрасным защитным средством, которым можно обрабатывать садовые культуры от вредителей. Разведенный порошок эффективен против садовых и огородных вредителей, прекрасно борется с грибковыми и бактериальными болезнями, плесенью.
Для обработки сада и огорода широко используется и железный купорос . Препарат представляет собой кристаллический порошок зеленоватого цвета, хорошо растворяется в воде. После приготовления раствора его нужно сразу же применить в деле, так как на воздухе он быстро окисляется. Его вполне можно использовать в виде жидкого удобрения. Подкормки вносятся для обогащения истощенного или бедного грунта.
Жидким железистым раствором обрабатывают деревья против грибковых болезней. Порошок эффективно себя показывает в борьбе с паршой, мучнистой росой любого вида, вредоносными насекомыми на любой стадии их развития, серой гнилью. Эффективен против коккомикоза, поражающего вишневые деревья, антракноза – поросли малины, оидиума – виноградные лозы, обрабатывают составом растения, которые поражены хлорозом неинфекционного характера.
Хелаты
Сульфат железа (II) — хелат железа — часто путают с сульфатом 3-валентного железа (III) – железным купоросом. Да, сульфат железа (III) в разы дешевле хелата, но предназначение и действие его иное.
Более-менее опытные растениеводы знают, что летние подкормки дело довольно сложное – вследствие погодных условий растения легко перекормить или обжечь. Поэтому ведущие производители сельхозхимии для мелких хозяйств выпускают специальные летние удобрения в хелатных формах.
В виде порошка и в др. чистых твердых формах хелат железа на воздухе и свету нестоек, поэтому в продажу поступает или в виде таблеток со связующими и стабилизаторами, или в жидком виде (концентрированный раствор). Его действие специфично, хелат железа содержит всего один микроэлемент, но зато очень важный – ионы 2-валентного железа. Особенно эффективно удобрение хелатом железа в сочетании с бором сильно истощающих почву культур, таких как клубника, редис и т.п.Маточный раствор в прикрытой (не закупоренной герметически) или не полностью заполненной большой посуде, напр. , пластиковой бутылке, хранится 2 недели; рабочий раствор должен быть использован немедленно. Вскрытие упаковки срока хранения не уменьшает, если она после отбора порции была немедленно закупорена.
, пластиковой бутылке, хранится 2 недели; рабочий раствор должен быть использован немедленно. Вскрытие упаковки срока хранения не уменьшает, если она после отбора порции была немедленно закупорена.
При наличии у растений признаков медного голодания быстро поправить дело поможет хелат меди . Полезные неорганические вещества помещаются внутрь органической молекулы, растение воспринимает такую подкормку гораздо лучше, хорошо усваивает ее. Препарат при правильном применении практически не вызывает появления ожогов на листьях растений и полностью усваивается через их листовую поверхность.
Медный купорос и железный купорос разница в применении. Медный или железный купорос? Выбирай с умом
Для получения хороших урожаев принято садовые деревья обрабатывать от вредителей и заболеваний. Не очень хочется применять фунгициды, поэтому предпочтительнее воспользоваться проверенными годами средствами. К ним можно отнести медный и железный купорос.
Главное отличие между этими препаратами в воздействии на культуры. Медным купоросом позволяется опрыскивать листву, а вот железным купоросом обрабатывают деревья и кустарники до распускания почек или поздней осенью. Препарат может сжечь нежную зеленую листву. Рассмотрим более детально оба средства.
Медным купоросом позволяется опрыскивать листву, а вот железным купоросом обрабатывают деревья и кустарники до распускания почек или поздней осенью. Препарат может сжечь нежную зеленую листву. Рассмотрим более детально оба средства.
Медный купорос
Сульфат меди является прекрасным защитным средством, которым можно обрабатывать садовые культуры от вредителей. Кристаллический порошок с металлическим привкусом – это проверенное не одним десятилетием неорганическое средство.
По сути, медный купорос – это сильнейший фунгицид, антисептическое средство, к тому же ещё и удобрение. При его использовании нужно строго придерживаться дозирования в процессе обработок, как правильно разводить препарат.
Свойства медного купороса
- внешне средство представляет собой голубые кристаллы, не имеющие запаха;
- гранулы прекрасно растворяются в воде;
- медный купорос пагубно воздействует на грибковые штаммы и вредителей;
- для людей порошок безопасен;
- не обладает токсичностью;
- на севооборот не оказывает негативного воздействия.

Применение
Медный купорос эффективен против садовых и огородных вредителей. Прекрасно борется с грибковыми и бактериальными болезнями, плесенью, например, с фитофторозом.
Препарат можно использовать в качестве дезинфицирующего средства. К примеру, оно отлично защищает древесину от гниения. Также жидким медным раствором можно обрабатывать от плесневелого грибка подвальные стены, потолок. Обрабатывающие процедуры лучше проводить ранней весной.
Общая информация о медном купоросе
- Не стоит использовать кристаллический порошок для обработок в жаркую погоду, иначе можно обжечь листву. Опрыскивают с особой осторожностью.
- При частом применении препарат делает фосфор в почве плохо усваиваемым.
- Разводить гранулы нужно в эмалированной посуде, так как с металлом медный купорос быстро входит в реакцию и теряет при этом свои свойства.
- Препарат используется для обработки садовых культур.
Раствор медного купороса
Ранней весной можно сделать заготовку, которой впоследствии можно пользоваться на протяжении всего сезона. Для этого разводят кристаллический порошок в воде и готовят концентрированную смесь медного купороса, равную 10%.
Для этого разводят кристаллический порошок в воде и готовят концентрированную смесь медного купороса, равную 10%.
Готовую жидкость закупоривают и ставят в темное место, например, подвальное помещение. Обрабатывать можно как растительность, так и почвенный грунт вокруг культур.
Железный купорос
Для обработки сада и огорода широко используется железный сульфат. С виду препарат представляет собой кристаллический порошок зеленоватого цвета. Он хорошо растворяется в воде. После разведения железный купорос нужно сразу же применить в деле, так как на воздухе он быстро окисляется.
Применение
Жидким железистым раствором обрабатывают деревья против грибковых болезней. Порошковое средство эффективно себя показывает в борьбе с паршой, мучнистой росой любого вида, вредоносными насекомыми на любой стадии их развития, серой гнилью. Эффективен против коккомикоза, поражающего вишневые деревья, антракноза – поросли малины, оидиума – виноградные лозы.
Первичное опрыскивание в саду проводится ранней весной, пока почки не распустились или поздней осенью – после листопада.
Железный купорос – удобрение
Зеленоватый кристаллический порошок в саду и огороде вполне можно использовать в виде жидкого удобрения. Подкормки вносятся для обогащения обедненного грунта. Подливают составом растения, которые поражены хлорозом неинфекционного характера.
Для лечебных опрыскиваний и обработок следует приготовить 3-5% жидкий раствор железного купороса. При выявленных заболеваниях обработки проводят несколько раз, при этом как опрыскивается листва, так и поливается приствольный круг вокруг дерева или кустарника.
Как только растительность оживает после болезни, листва приобретает здоровый зеленый цвет, культура идет на поправку. В профилактических целях в саду проводят опрыскивания 1% жидким раствором.
Сегодня садоводы и огородники полюбили железистый хелат. Препарат представляет собой микроудобрение отменного качества, которое изготовляется на основе железного купороса.
Не стоит пренебрегать народной мудростью, в копилке которой имеется множество старинных эффективных рецептов, направленных на борьбу со многими садово-огородными вредителями и заболеваниями.
Железный купорос для защиты растений от болезней, вредителей и удобрения культур
Железный купорос – это простое название сульфата двухвалентного железа (формула: FeSO4). Благодаря цене и доступности получил широкое распространение. Большой плюс кроется в том, что он не влияет на вкус плодов, и не накапливается в них.
В садоводстве используется в качестве инсектицида (против насекомых), фунгицида (против грибка) и корневого, внекорневого удобрения на бедных и истощенных почвах.
Удобрение имеет неорганическое происхождение, а потому известно в агротехнологии более, чем ста лет. За это время соединение доказало свою пользу в сельском хозяйстве.
Не следует его путать с медным купоросом – они имеют разные воздействия. Схожее название получили из-за того, что многие вещества с серой раньше называли купоросом. Потому сравнивать, что лучше: медный или железный купорос – не корректно.
Как и любой другой химикат в сельском хозяйстве, он требует осторожного обращения.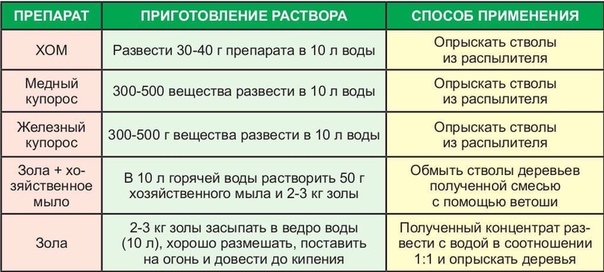 Хоть сернокислое железо является малотоксичным соединением, оно все равно способно нанести вред.
Хоть сернокислое железо является малотоксичным соединением, оно все равно способно нанести вред.
Что такое железный купорос: состав, свойства и правила использования
Действующих вещества сразу 2: железо и сера. Они, во-первых, губительны для вредителей, во-вторых, нужны для нормального развития всем растениям. Влияют на состояние зеленой надземной части и на урожайность (количество и качество плодов).
Железный купорос для растений полезен по 3 причинам:
- Он помогает бороться с дефицитом железа в почве. Металл, который находится в основе химического вещества прост в усвоении, что позволяет за несколько применений получить заметный эффект.
- Подходит для профилактики уничтожения насекомых-паразитов, которые живут под корой. В таких случаях наносится при помощи опрыскивателя, добавляется в смесь для побелки. Опытные садоводы советуют использовать его весной и осенью вне зависимости от того, есть ли в вашей местности риск появления вредителей.
- Сульфат железа вызывает усыхание мягких тканей растений.
 Благодаря этому он подходит для удаления с коры мха, лишайника и паразитических грибов, с которыми сложно борются другие средства защиты растений. Например, доказан эффект в выведении парши, мучнистой росы, антракноза.
Благодаря этому он подходит для удаления с коры мха, лишайника и паразитических грибов, с которыми сложно борются другие средства защиты растений. Например, доказан эффект в выведении парши, мучнистой росы, антракноза.
Наносится при помощи распылителя или добавляется в побелку. Оптимальное время применение: весной до почкования или же осенью после опадания листьев.
Состав
Железный купорос – неорганическое вещество. В его состав входит сера (сульфур, S), кислород (оксиген, O) и железо (ферум, Fe). Первые два образуют кислотный остаток SO4, который является составной частью всех сульфатов. Отсюда другие названия удобрения сульфат железа – сернокислотное железо. Все элементы, которые входят в состав полезны для растений. Хорошо заметен эффект при удобрении, если следить за цветом листьев. Так, они становятся более зелеными и яркими.
Железный купорос – это соль. Он существует в виде мелких кристаллов светло-зеленого или серо-зеленого цвета. Как и большинство солей он хорошо растворяется в воде. Это свойство очень полезно, ведь позволяет наносить вещество при помощи опрыскивателя.
Это свойство очень полезно, ведь позволяет наносить вещество при помощи опрыскивателя.
В закрытой упаковке железный купорос можно хранить неограниченный промежуток времени. В отличие от органических химикатов он не портится. Если упаковка уже была открыта, порошок следует пересыпать в другую емкость, которая плотно закрывается. Такая манипуляция нужна, чтобы защитить от воды и воздействия солнечного света. Для этого хорошо подходят пластиковые ведра с крышкой (в таких хранится краска, грунтовка).
Использование железного купороса
Кислотность раствора на основе купороса безопасна для растений, но достаточна, чтобы бороться с микроорганизмами и другими вредителями. Поэтому им проводят дезинфекцию после обрезки илиестественного травмирования веток или ствола деревьев.
Больше всего применяется железный купорос в садоводстве, реже – в огородничестве. Практически нет случаев, когда он был полезен для домашних растений, которые выращивают в горшках, цветов. Наносят его на деревья, кусты, виноград. При попадании на молодой побег или лист, вызывает постепенное усыхание. Не применяют во время цветения, чтобы не нанести вреда пчелам, так как это приведет к плохому опылению. Как следствие – урожайность от плодовых деревьев и ягодных кустов падает.
При попадании на молодой побег или лист, вызывает постепенное усыхание. Не применяют во время цветения, чтобы не нанести вреда пчелам, так как это приведет к плохому опылению. Как следствие – урожайность от плодовых деревьев и ягодных кустов падает.
Области применения
Две основные области использования железного купороса – в качестве удобрения и ядохимиката. Раствор для внекорневого удобрения делают с расчета 50 г на 10 литров воды. Подходит для подкормки как овощей, так и садовых растений. Также хороший эффект показывает внесение с органической массой. Например, на 10 кг компоста добавляют 100 г железного купороса.
В качестве яда он подходит для борьбы с насекомыми, грибком и лишайниками. Концентрация при этом больше. Так, для вредителей на 10 л воды добавляют 500 г железного купороса, против лишайников и мхов (появляются в больших количествах на коре старых деревьев) – 300 г.
Менее распространенная область использования – весенние заморозки. Дело в том, что железный купорос может замедлить появление почек. Если после оттепели прогнозируется резкое похолодание, используется раствор купороса, благодаря чему деревья «просыпаются» позже на неделю.
Если после оттепели прогнозируется резкое похолодание, используется раствор купороса, благодаря чему деревья «просыпаются» позже на неделю.
Эффективность
Обратите внимание, что положительный эффект будет достигаться только при правильной дозировке. Для борьбы с разными паразитами, удобрения, замедления развития почек используется разная концентрация вещества.
Вне зависимости от сферы и цели, которую преследует садовод, положительный эффект от использования длиться до 2 недель. Также нужно быть аккуратным, смешивая железный купорос с другими активными добавками. Так, кальций существенно ухудшает его усвояемость в качестве растения. Важным моментом является регулярность. Например, для борьбы с лишайником или насекомыми, необходимо распыление каждую неделю в течение около одного месяца. Конкретные концентрации и периодичность производитель обычно указывает на упаковке.
Также железный купорос нельзя совмещать с щелочными удобрениями, поскольку они вступают в реакцию и нейтрализуют друг друга.
Меры предосторожности
Перед тем, как разводить железный купорос, убедитесь в правильности дозировки. Используйте перчатки и очки. Проще соль разводится, если ее сначала растворить в небольшом количестве жидкости. Лучше процесс пойдет, если воду предварительно подогреть. Потом полученную смесь выливают в воду и размешивают. Таким образом раствор получается хорошим, поскольку действующее вещество равномерно распределяется по всему объему воды. После этого оставьте железный купорос постоять 20-30 минут. Полученная жидкость будет иметь от светло-зеленого до ярко изумрудного цвет.
Поскольку у раствора кислотность повышена, то для работы используют стеклянную или пластиковую посуду. Они не реагируют с купоросом, а железо или другие металлы быстро начинают ржаветь. По той же причине для размешивания используют деревянные или пластиковые лопатки.
Железный купорос при обработке почвы: плюсы
Наряду с высокой эффективностью, одним из важных преимуществ является низкая цена. Так, в Украине 1 кг железного купороса можно купить за 10-25 гривен. Таким образом, исходя из средней цены, можно дешево обработать большое количество растений, что важно для фермеров, которые содержат обширные сады.
Так, в Украине 1 кг железного купороса можно купить за 10-25 гривен. Таким образом, исходя из средней цены, можно дешево обработать большое количество растений, что важно для фермеров, которые содержат обширные сады.
Спектр применения не ограничивается плодовыми деревьями. Также железный купорос подходит для удобрения овощных культур, реже используется цветоводами. Бороться он позволяет со всеми паразитами, с которыми можно столкнуться в умеренном климатическом поясе.
Но, пожалуй, самым большим плюсом железного купороса является низкая токсичность. Вещество неорганическое, а значит, легко распадается в естественных условиях. Железо не накапливается в плодах растений, а потому не будет наносить вред организму при употреблении их в пищу.
Железный купорос при обработке почвы: минусы
Есть у удобрения и недостатки. Они связаны с дозировкой, ограниченным сроком использования и рисками, которые возникают при работе с молодыми растениями.
Разводить железный купорос можно в разных концентрациях. На 10 литров его могут добавлять от 50 г до половины килограмма. От количества действующего вещества будет зависеть и эффект, который будет получен в итоге.
На 10 литров его могут добавлять от 50 г до половины килограмма. От количества действующего вещества будет зависеть и эффект, который будет получен в итоге.
Само низкое содержание железного купороса, когда он используется в качестве удобрения. Если нужно провести дезинфекцию повреждений, то на 1 литр воды добавляют 10 г купороса (обычное соотношение 100 г на 10 л, но обычно такого количества для дезинфекции будет много). Больше всего порошка тратится при уничтожении насекомых – 500 г на 10 л, и лишайников – 300 г на 10 л. Купить инсектициды, которые эффективно уничтожают вредителей можно в Бизон-Тех.
Быстрое окисление жидкости
Еще один недостаток железного купороса – относительно невысокий срок эффективности. После нанесения на кору растения, положительное воздействие будет длиться от 10 до 14 дней. Связано это с тем, что после растворения в воде, препарат начинает активно реагировать с оксигеном, который является одним из составляющих веществ воздуха. Как итог, купорос трансформируется (превращается в сульфат трехвалентного железа) и полностью утрачивает полезные свойства.
С этим фактором связана периодичность нанесения: чтобы добиться нужного эффекта, процедуру повторяют через 5-7 дней.
Риски при обработке весной
По инструкции железный купорос для профилактики используют два раза в год: весной и осенью. Такое время выбрано, чтобы максимально снизить вероятность нанесения вреда, ведь при попадании на зеленые части, сульфат вызывает их отмирание.
Особенно аккуратным нужно быть весной. После появления почек, ветки железным купоросом обрабатывать нельзя. Допустимо наносить его только на одеревеневшие части. Опасность для листьев и побегов связана с тем, что водный раствор купороса обладает повышенной кислотностью. Даже в 2%-м растворе достаточно кислоты, чтобы вызвать ожог, увядание и даже полное отмирание молодого растения.
Содержание до 1% не наносит вреда, но и положительный эффект также практически не заметен. Отсюда следует вывод, что разводить железный купорос нужно по инструкции. Причем соотношение в рецепте будет отличаться от цели (удобрение или борьба с паразитами) и времени нанесения.
Железный купорос – одно из важнейших для садовода веществ в борьбе и профилактике грибковых болезней и вредителей. Удобрение помогает решить проблему дефицита железа в почве, позволяет сохранить высокую урожайность при весенних заморозках.
При использовании вещества нужно придерживаться следующих правил:
- соблюдать дозировку;
- пользоваться перчатками и защитными очками;
- не наносить на листья и молодые побеги.
Если следовать этим рекомендациям, то сульфат железа будет приносить пользу и как удобрение, и как ядохимикат для борьбы с паразитами.
Медный купорос – простое и эффективное средство для профилактической обработки виноградника
Виноградные кусты, как и прочие жители садов и огородов, требуют грамотного ухода. В арсенале химической промышленности есть сотни препаратов, улучшающих рост и предотвращающих заболевания растений. Однако для поддержания здоровья лозы можно обойтись доступным средством — медным купоросом.
Можно ли опрыскивать виноград медным купоросом
Прежде чем применять какое-либо средство, необходимо убедиться в его безопасности для растения. Поэтому для начала рассмотрим, что такое медный купорос и как он влияет на виноградную лозу.
Нельзя путать медный и железный купорос! В их составе разный базовый микроэлемент.
Слева кристаллы железного купороса, помогающего бороться с с лишайниками и мхом, а справа — медного, который защищает виноград от милдью и оидиума
Таблица: сравнительные характеристики медного и железного купороса
В состав медного купороса входит соль серной кислоты, которая уничтожает паршу, гниль, пятнистости на кустарниках, и медь, являющаяся подкормкой для растений аналогично железу, магнию, хрому и прочим микроэлементам. Поэтому обработка медным купоросом важна для развития виноградного куста. Однако не стоит забывать, что избыток питания так же опасен, как и недостаток. К тому же сернокислая медь обжигает молодые побеги и листочки, что приводит к их гибели. В применении любых средств важен разумный подход — это залог успеха.
В применении любых средств важен разумный подход — это залог успеха.
В каких случаях виноград обрабатывается медным купоросом
В садоводстве и виноградарстве обработка медным купоросом производится для борьбы с болезнями и в качестве подкормки. В зависимости от выбранной цели устанавливаются сроки проведения опрыскивания и выбирается дозировка препарата.
Подкормка
Для подкормки винограда медный купорос, как и прочие минеральные удобрения, целесообразен на бедных песчаных почвах и торфяниках, но не на чернозёме. Медь участвует в фотосинтезе и увеличивает сопротивляемость грибковым заболеваниям. Повреждение виноградной лозы болезнями — это следствие недостаточного питания, в том числе и дефицита меди. Признаком того, что растению не хватает этого микроэлемента, является слабое развитие молодых побегов и побеление кончиков листьев. Для подкормки, которую проводят по листьям до цветения, используют следующую дозировку: 2–5 г медного купороса на 10 л воды.
Недостаток меди у винограда проявляется побелением кончиков листьев, обычно на торфяных и песчаных почвах
Нельзя допускать и переизбытка меди в почве: в таком случае будет угнетаться рост виноградного куста. Поэтому, если после обработки медным купоросом прошёл дождь, можно проводить повторное опрыскивание не ранее чем через месяц.
Обработка от грибковых заболеваний
В качестве фунгицида сернокислая медь эффективна в профилактике:
- парши,
- бурой пятнистости,
- белой пятнистости,
- мучнистой росы.
Также за счёт того, что в растворённом состоянии медь имеет кислую реакцию, препарат останавливает развитие микозов.
Чтобы после опрыскивания защитная плёнка держалась на лозе, в раствор нужно добавить прилипатели. Это могут быть:
- жидкое хозяйственное мыло,
- стиральный порошок,
- обезжиренное молоко.
Достаточно 100 г вещества на ведро воды. В результате препарат будет держаться на растении, его не смоет внезапный дождь.
Поскольку образовавшееся покрытие не проникает вглубь ветви, в лечебных целях следует применять специальные средства: Ридомил Голд, Строби, Кабрио Топ или подобные им препараты.
Раствор сернокислой меди в концентрации 1–3% применяется для замачивания саженцев перед посадкой. Такая обработка предотвратит заражение грибковыми болезнями.
Замачивание саженцев винограда перед посадкой в 1–3%-м растворе сернокислой меди предотвратит заражение грибковыми заболеваниями
В какое время лучше обрабатывать виноградник
Сроки опрыскивания винограда медным купоросом зависят от того, для чего проводится процедура. Существуют три сезонные обработки:
- осенняя — основная, для уничтожения бактерий и грибков;
- весенняя — дополнительная, для дезинфекции и профилактики заболеваний;
- летняя — вспомогательная, для подавления активности вредителей.
Исходя из этого можно определить, что предпочтительной является обработка медным купоросом лозы осенью, но нельзя исключать важность весенней и вероятность летней процедур. Рассмотрим их подробнее.
Рассмотрим их подробнее.
Обработка винограда медным купоросом осенью
Процедура проводится после сбора урожая и полного опадания листвы. В зависимости от региона это может быть как начало, так и конец ноября. Главное, чтобы куст уже подготовился к зиме. В этом случае уже не страшно попадание препарата на опадающую листву, главное — полностью оросить лозу и уберечь растение от заражения. Перед обработкой виноградную лозу связывают пучком вдоль шпалеры.
При обработке винограда раствором медного купороса осенью лозу следует связать в пучки
Прежде чем проводить процедуру, следует убрать и сжечь повреждённые ветви и опавшую листву. Это предотвратит повторное заражение болезнетворными спорами.
Обработка проводится в такой последовательности:
- 100 г медного купороса растворяют в 1 л тёплой (50 °C) воды в стеклянной таре. Нержавеющая или эмалированная посуда не подойдёт — препарат может вступать в реакцию и разрушить металл и эмаль.
- Тщательно перемешивают, доводят раствор до 10 л и заливают в бак опрыскивателя.
 При заливании лучше использовать фильтр, так как частички медного купороса могут остаться нерастворёнными.
При заливании лучше использовать фильтр, так как частички медного купороса могут остаться нерастворёнными. - Опрыскивают виноград, стараясь, чтобы раствор попал на всю лозу.
Видео: обработка лозы медным купоросом осенью
Обработка винограда медным купоросом весной
Чтобы не сжечь нежную зелень, процедуру надо проводить до распускания почек. Можно начинать обработку только тогда, когда температура устойчиво будет держаться не ниже +5 °C. Это важное условие, поскольку медь способствует ускоренному охлаждению растений, что станет губительным для почек, молодых листочков при вероятных весенних заморозках.
Порядок действий таков:
- Лозы освобождают от зимнего укрытия и приподнимают над землёй, закрепляя на шпалерах для просыхания.
- Через 1–2 дня готовят раствор медного купороса из расчёта 100 г на 10 л воды таким же образом, как для осенней обработки.

- Обрабатывают лозу со всех сторон.
Видео: обработка лозы медным купоросом весной
Обработка винограда медным купоросом летом
Летняя обработка проводится в крайних случаях: чтобы не применять сильнодействующие лечебные препараты, если обнаружились первые признаки заболевания. Для опрыскивания следует готовить слабые растворы — 0,5%-е, а для примочек лозы против лишайников и оидиума — 3%-е.
Дозировка медного купороса для различных обработок
Поскольку избыток меди опасен для растений, то для различных целей применяются строго определённые дозировки:
- 0,5% — 50 г на 10 л воды для экстренной обработки по зелёным листьям;
- 1% — 100 г на 10 л воды для весенней обработки;
- 3% — 30 г на литр воды для борьбы с паршой;
- 5% — 50 г на литр воды — обработка осенью старых мощных кустов.

Чаще применима обработка виноградников бордоской жидкостью (сочетание медного купороса с известью в пропорции 1:1). В таком случае концентрацию сернокислой меди можно увеличить до 10%. Для того чтобы смесь гарантированно осталась на ветвях, в раствор следует добавить жидкое хозяйственное мыло из расчёта 50 г на литр (или натереть на тёрке и растворить в воде кусковое). Обрабатывать необходимо до полного смачивания ветвей. Ориентировочный расход составит:
- около 1,5–2 л на один рукав (так называют многолетнюю ветвь) средних размеров,
- 3,5–4 л на крупный, хорошо развитый куст.
Видео: правила приготовления бордоской жидкости
Порядок приготовления раствора:
- Подготовить стеклянную тару для смешивания.
- В 5 л тёплой воды добавить порошок медного купороса и размешать до полного растворения:
- 100 г для приготовления 1%-го раствора;
- 300 г для приготовления 3%-го раствора.

- Гашёную известь развести сначала в литре тёплой воды, затем довести объём раствора до 5 л:
- 100–150 г для приготовления 1%-го раствора;
- 300–400 г для приготовления 3%-го раствора.
- Добавить мыло или другой прилипатель в известковое молочко.
- Смешивать оба раствора: в известковое молочко вливать растворённый купорос.
- Перемешивать следует осторожно, не допуская образования пены и брызг.
- Полученный состав необходимо процедить через фильтр. Использовать сразу, хранить смесь нельзя.
Правила безопасности при работе с медным купоросом
При обработке лозы бордоской жидкостью необходимо соблюдать меры безопасности
Чтобы принести пользу лозе и не навредить своему здоровью, при изготовлении и использовании раствора медного купороса или бордоской жидкости следует придерживаться правил:
- защищать кожу от попадания готового препарата — надевать закрытую одежду, обувь и маску;
- не добавлять в раствор прочие ингредиенты, кроме медного купороса, извести и мыла;
- опрыскивать виноградник вечером или рано утром — так капли дольше продержатся на ветках и не испарятся под лучами солнца;
- обрабатывать при сухой, безветренной погоде.
 Во время дождя никакие манипуляции не проводятся, а ветер помешает равномерно нанести препарат на лозу;
Во время дождя никакие манипуляции не проводятся, а ветер помешает равномерно нанести препарат на лозу; - опрыскивать не только куст, но и опору, на которой он подвязан, поскольку она может быть переносчиком возбудителей болезней и грибковых спор.
Если приходится проводить летнюю обработку, делать это следует не позднее чем за месяц до предполагаемого сбора урожая. В составе медного купороса есть соль серной кислоты, которая при попадании внутрь организма станет причиной отравления.
Поскольку известковая взвесь оседает на дно посуды, раствор необходимо перемешивать в процессе опрыскивания, иначе сначала на куст попадёт вода, а затем сильно концентрированный препарат.
Необходимо следить, чтобы вся поверхность лозы была орошена, при этом нельзя допускать обильного полива почвы под кустом. Можно просто застелить землю плёнкой, но лучше применять мелкодисперсные распылители направленного действия — ручные помповые или электрические аппараты.
Порядок работы (независимо от времени обработки) следующий:
- Сначала обрабатывают верх куста.
- Затем опрыскивают средний ярус.
- Следующим этапом наносят средство на рукава и ствол.
- В завершение орошают опору.
Мундштук аппарата следует держать на расстоянии около 10–20 см от ветви, а струю при этом направлять по лозе сверху вниз.
Ручной опрыскиватель удобен для обработки пары кустов винограда, а электрический пригодится для большого виноградника
Медный купорос — эффективный препарат для минеральной подкормки и профилактики грибковых заболеваний. Однако, используя его для обработки виноградника, не стоит пренебрегать правилами, и тогда ваши растения ответят на заботу отличным урожаем!
Здравствуйте! Меня зовут Елена. Мне 40 лет. Оцените статью: Поделитесь с друзьями!Железный купорос или медный: что для винограда лучше?
Опасность подстерегает виноград там, где ее никто не ждет. То есть под зимним укрытием. При укрытии на лозах получаются микротрещины коры, через которые могут проникать грибки. Почки и лозы повреждают плесень и гнили. Чтобы этого избежать, перед укрытием необходимо провести обработку лоз медным или железным купоросом.
То есть под зимним укрытием. При укрытии на лозах получаются микротрещины коры, через которые могут проникать грибки. Почки и лозы повреждают плесень и гнили. Чтобы этого избежать, перед укрытием необходимо провести обработку лоз медным или железным купоросом.
ДЛЯ ЧЕГО НУЖНА ОБРАБОТКА
Ничего хорошего от контакта лоз с грибками ждать не приходится. Эти паразиты начинают свое черное дело задолго до пробуждения почек – в зимние оттепели. Есть даже одна плесень, которая так и называется – снежная (она развивается под снегом).
Чтобы этого не допустить, виноград обрабатывают фунгицидами. Опытные садоводы отдают предпочтение медному или железному купоросу. Несмотря на то, что у них похожие названия, перепутать, даже внешне, их невозможно.
ЖЕЛЕЗНЫЙ КУПОРОС
У него структура как у крупной соли и зеленый цвет. За это препарат часто называют зеленым. При его растворении вода становится зеленоватой, иногда немного желтоватой.
Совет от «Хозяйства»
Помните, что приготовленный раствор нельзя хранить и лучше использовать в течение двухтрех часов.
Считается, что железный купорос несколько снижает морозостойкость кустов. Но это не страшно, потому что мы все равно его укрываем.
Перед опрыскиванием удаляются все лишние лозы и убирается вся листва. Полезный эффект еще и в том, что обработанные кусты позже распускают почки. То есть виноград уходит от заморозков.
МЕДНЫЙ КУПОРОС
У него светло-голубой или синий цвет и порошковидная структура с мелкими кристаллами. Под действием солнечных лучей кристаллы могут приобретать белый или серый оттенок. Вне зависимости от этого при растворении вода становится темно-синей и с характерным запахом.
Защитный эффект от обработки медного купороса дольше, чем у железного. Раствор быстро впитывается и предотвращает развитие плесени и грибков.
ПРОЦЕСС ОБРАБОТКИ
Оптимальной пропорцией разведения железного купороса является следующая: 300-500 г на 10 л воды. Раствор очень крепкий, но спящим почкам винограда он вреда не принесет. После опрыскивания лозы становятся черными, как бы обугленными, – это нормально. Через два-три дня обработанный виноград можно укрывать на зиму.
Раствор очень крепкий, но спящим почкам винограда он вреда не принесет. После опрыскивания лозы становятся черными, как бы обугленными, – это нормально. Через два-три дня обработанный виноград можно укрывать на зиму.
Принцип обработки медным купоросом абсолютно такой же. Единственное, стоит рассказать о пропорции – на 10 л воды понадобится 100-150 г синего порошка. Как и в предыдущем случае, раствор необходимо размешивать до тех пор, пока все полностью не растворится.
ПАМЯТКА
Применяйте перчатки, респиратор и очки при работе с этими препаратами и их растворами.
Совет от «Хозяйства»
Никогда не смешивайте железный и медный купорос. Некоторые добавляют в раствор немного уксуса – делать этого нельзя, сильно снизится убойность раствора, да и виноград может получить ожоги.
Гашеную известь можно добавлять только к медному купоросу, но не к железному!
Если соблюдать эти нехитрые правила, то такие ежегодные обработки положительно скажутся и на кустах, и на урожае винограда. {2+} + 2e- & <=> Fe} & -0.0_ \ text {(Fe3)} & = 0,342 ~ \ mathrm {V} — (-0,037 ~ \ mathrm {V}) = 0,379 ~ \ mathrm {V}
\ end {align} $$
{2+} + 2e- & <=> Fe} & -0.0_ \ text {(Fe3)} & = 0,342 ~ \ mathrm {V} — (-0,037 ~ \ mathrm {V}) = 0,379 ~ \ mathrm {V}
\ end {align} $$
Понятно, что реакция (Fe2) выделяет больше энергии, и поэтому ее следует предпочесть другой реакции. Это означает, что мы ожидаем выхода 100% Cu, а не 150% Cu.
Теперь, когда мы собрали некоторое теоретическое понимание этого вопроса, давайте перейдем к интересной части, а именно
Вы правильно рассчитали теоретический выход меди равным 0.89 г и 1,33 г соответственно. Соответствующие количества меди составляют 0,014 моль и 0,021 моль.
Вы измерили количество произведенной меди, и оно составляет 0,78 г. Это уже убедительное указание на то, что мы должны встать на сторону (Fe2) в этом вопросе. Но чтобы быть уверенным, давайте посмотрим на ошибку, которая была бы у нас, если бы она была (Fe3):
$$ \ varepsilon = \ frac {\ Delta x} {x} = 41,4 \% $$
Это очень большая ошибка, особенно по сравнению с ошибкой для (Fe2), которая составляет всего 12,1%. Предполагая, что вы проводили реакцию не с чистым Fe, а со смесью железа с некоторыми оксидами железа в качестве примесей, не использовали аналитическую шкалу и проводили эксперимент в довольно неконтролируемых условиях (уверены ли вы, что реакция завершилась, когда вы прервали?) эта ошибка не так плоха, как кажется.
Предполагая, что вы проводили реакцию не с чистым Fe, а со смесью железа с некоторыми оксидами железа в качестве примесей, не использовали аналитическую шкалу и проводили эксперимент в довольно неконтролируемых условиях (уверены ли вы, что реакция завершилась, когда вы прервали?) эта ошибка не так плоха, как кажется.
Теперь, когда экспериментальные результаты у нас в кармане, мы можем перейти к последней части:
Мы показали, используя теоретические предсказания и экспериментальное подтверждение, что наблюдаемая реакция была окислением железа до железа (II) при восстановлении меди (II) до меди.
Между прочим, большинство расчетов я проделал с помощью iPython Notebook, который вы можете просмотреть здесь. Я мог что-то напутать, мало ли.
Электрохимия | Химия для неосновных
- Опишите использование серии операций таблицы металлов.
- Предскажите спонтанность реакции на основе таблицы рядов активности.
Сколько стоит это ожерелье?
Золото и серебро — широко используемые металлы для изготовления украшений. Одна из причин, по которой эти металлы используются для этой цели, заключается в том, что они очень инертны. Они не вступают в реакцию с большинством других металлов, поэтому с большей вероятностью останутся нетронутыми в сложных условиях. Кто хочет, чтобы их любимое украшение развалилось на них?
Одна из причин, по которой эти металлы используются для этой цели, заключается в том, что они очень инертны. Они не вступают в реакцию с большинством других металлов, поэтому с большей вероятностью останутся нетронутыми в сложных условиях. Кто хочет, чтобы их любимое украшение развалилось на них?
Прямые окислительно-восстановительные реакции
Когда полоска металлического цинка помещается в синий раствор сульфата меди (II) ( Рис. ниже), немедленно начинается реакция, когда полоска цинка начинает темнеть.Если оставить в растворе более длительный период времени, цинк будет постепенно разлагаться из-за окисления до ионов цинка. В то же время ионы меди (II) из раствора восстанавливаются до металлической меди (см. Рисунок ниже), в результате чего синий раствор сульфата меди (II) становится бесцветным.
Рисунок 23.1
Раствор медного купороса.
Рисунок 23.2
Реакция металлического цинка в растворе сульфата меди.
Процесс, который происходит в этой окислительно-восстановительной реакции, показан ниже как две отдельные полуреакции, которые затем могут быть объединены в полную окислительно-восстановительную реакцию.
Почему эта реакция происходит самопроизвольно? Серии действий — это список элементов в порядке убывания их реактивности. Элемент, который находится выше в ряду активности, способен вытеснить элемент, который находится ниже в ряду в реакции одиночного замещения. В этой серии также перечислены элементы в порядке легкости окисления.Верхние элементы окисляются легче всего, а нижние — сложнее всего. В приведенной ниже таблице Таблица показывает ряд активности вместе с полуреакцией окисления каждого элемента.
| Серия активности металлов (в порядке химической активности) | ||
|---|---|---|
| Элемент | Половина реакции окисления | |
| Литий | Li ( s ) → Li + ( водн. ) + e — ) + e — | Наиболее активен или наиболее легко окисляется |
| Калий | K ( с ) → K + ( водн. ) + e — | |
| Барий | Ba ( с ) → Ba 2+ ( водн. ) + 2e — | |
| Кальций | Ca ( с ) → Ca 2+ ( водн. ) + 2e — | |
| Натрий | Na ( с ) → Na + ( водн. ) + e — | |
| Магний | Mg ( s ) → Mg 2+ ( водн. ) + 2e — | |
| Алюминий | Al ( с ) → Al 3+ ( водн. ) + 3e — | |
| Цинк | Zn ( с ) → Zn 2+ ( водн. ) + 2e — | |
| Утюг | Fe ( с ) → Fe 2+ ( водн. ) + 2e — ) + 2e — | |
| Никель | Ni ( с ) → Ni 2+ ( водн. ) + 2e — | |
| Олово | Sn ( с ) → Sn 2+ ( водн. ) + 2e — | |
| Свинец | Pb ( s ) → Pb 2+ ( водн. ) + 2e — | |
| Водород | H 2 ( г ) → 2H + ( водн. ) + 2e — | |
| Медь | Cu ( с ) → Cu 2+ ( водн. ) + 2e — | |
| Меркурий | Hg ( л ) → Hg 2+ ( водн. ) + 2e — | |
| Серебро | Ag ( с ) → Ag + ( водн. ) + e — | |
| Платина | Pt ( с ) → Pt 2+ ( водн. ) + 2e — ) + 2e — | |
| Золото | Au ( с ) → Au 3+ ( водн. ) + 3e — | Наименее активен или труднее всего окисляется |
Обратите внимание, что цинк указан над медью в серии активности, что означает, что цинк окисляется легче, чем медь.Вот почему ионы меди (II) могут действовать как окислитель при контакте с металлическим цинком. Ионы любого металла, который ниже цинка, например свинца или серебра, окислили бы цинк в аналогичной реакции. Эти типы реакций называются прямыми окислительно-восстановительными реакциями , потому что электроны текут непосредственно от атомов одного металла к катионам другого металла. Однако никакой реакции не произойдет, если полоску металлической меди поместить в раствор ионов цинка, потому что ионы цинка не способны окислять медь.Другими словами, такая реакция не спонтанна.
Сводка
- Приведен ряд активностей металлов.

- Описаны параметры самопроизвольных реакций между металлами.
Практика
Вопросы
Посмотрите видео по ссылке ниже и ответьте на следующие вопросы:
Нажмите на изображение выше, чтобы увидеть больше
- Что произошло, когда Mg и Zn были помещены в раствор Pb 2+ ?
- Прореагировала ли полоска Zn в растворе Mg 2+ ?
- Как было показано, что Ag наименее реактивен?
Обзор
Вопросы
- Какие металлы имеют высокие показатели активности?
- Какие металлы являются низкими в серии активности?
- Окисляется ли олово легче, чем магний?
- прямая окислительно-восстановительная реакция: Электроны текут непосредственно от атомов металла к катионам другого металла.
- Определить электрохимию.

- Опишите электрохимическую реакцию.
- Перечислите компоненты электрохимической реакции.
Что случилось с той скульптурой?
Металл, подвергающийся воздействию внешних элементов, обычно подвержен коррозии, если не защищен. Процесс коррозии представляет собой серию окислительно-восстановительных реакций с участием металла скульптуры. В некоторых случаях металлы намеренно оставляют незащищенными, чтобы поверхность претерпела изменения, которые могут повысить эстетическую ценность работы.
Электрохимические реакции
Химические реакции либо поглощают, либо выделяют энергию, которая может иметь форму электричества. Электрохимия — это раздел химии, который занимается взаимным преобразованием химической энергии и электрической энергии. Электрохимия широко применяется в повседневной жизни. Все виды батарей, от батарейки для фонарика и калькулятора до автомобиля, используют химические реакции для выработки электричества. Электричество используется для покрытия предметов декоративными металлами, такими как золото или хром.Электрохимия играет важную роль в передаче нервных импульсов в биологических системах. За всеми электрохимическими процессами стоит окислительно-восстановительная химия, перенос электронов.
Электричество используется для покрытия предметов декоративными металлами, такими как золото или хром.Электрохимия играет важную роль в передаче нервных импульсов в биологических системах. За всеми электрохимическими процессами стоит окислительно-восстановительная химия, перенос электронов.
Реакция металлического цинка с ионами меди (II) называется прямым окислительно-восстановительным процессом или реакцией. Электроны, которые переносятся в результате реакции, переходят непосредственно от атомов Zn на поверхности полоски к ионам Cu 2+ в области раствора рядом с цинковой полоской. Электричество, с другой стороны, требует прохождения электронов через проводящую среду, такую как провод, для выполнения работы.Этой работой может быть зажигание лампочки, включение холодильника или обогрев дома. Когда окислительно-восстановительная реакция прямая, эти электроны не могут работать. Вместо этого мы должны отделить процесс окисления от процесса восстановления и заставить электроны перемещаться из одного места в другое между ними. Это ключ к структуре электрохимической ячейки. Электрохимический элемент — это любое устройство, которое преобразует химическую энергию в электрическую или электрическую энергию в химическую энергию.
Это ключ к структуре электрохимической ячейки. Электрохимический элемент — это любое устройство, которое преобразует химическую энергию в электрическую или электрическую энергию в химическую энергию.
Электрохимическая реакция состоит из трех компонентов. Должен быть раствор, в котором могут возникнуть окислительно-восстановительные реакции. Эти реакции обычно происходят в воде, чтобы облегчить движение электронов и ионов. Для передачи электронов должен существовать проводник. Этот проводник обычно представляет собой какой-то провод, так что электроны могут перемещаться с одного места на другое. Ионы также должны иметь возможность перемещаться через солевой мостик, который облегчает миграцию ионов.
Сводка
- Электрохимия определена.
- Дано описание электрохимической ячейки.
- Перечислены компоненты электрохимической реакции.
Практика
Вопросы
Ознакомьтесь с материалом по ссылке ниже и ответьте на следующие вопросы:
http://bouman. chem.georgetown.edu/S02/lect25/lect25.htm
chem.georgetown.edu/S02/lect25/lect25.htm
- В какой системе происходят спонтанные реакции?
- В каком типе системы происходят непредвиденные реакции?
- Что есть потенциал?
- Как измеряется потенциал?
Обзор
Вопросы
- Что такое электрохимическая реакция?
- Какой тип химической реакции происходит?
- Что должно двигаться в электрохимической реакции?
- электрохимический элемент: Любое устройство, преобразующее химическую энергию в электрическую или электрическую энергию в химическую энергию.
- электрохимия: Раздел химии, посвященный взаимному преобразованию химической энергии и электрической энергии.
- Опишите устройство и функцию гальванического элемента.
Что заставило дергаться?
Луиджи Гальвани (1737-1798) был итальянским врачом и ученым, который проводил исследования нервной проводимости у животных. Его случайное наблюдение подергивания лягушачьих лапок при контакте с железным скальпелем, когда ноги висели на медных крючках, привело к исследованиям электропроводности в мышцах и нервах.Он считал, что ткани животных содержат «животное электричество», подобное естественному электричеству, которое вызывает образование молнии.
Его случайное наблюдение подергивания лягушачьих лапок при контакте с железным скальпелем, когда ноги висели на медных крючках, привело к исследованиям электропроводности в мышцах и нервах.Он считал, что ткани животных содержат «животное электричество», подобное естественному электричеству, которое вызывает образование молнии.
Гальванические элементы
Гальванический элемент — это электрохимический элемент, в котором для выработки электроэнергии используется спонтанная окислительно-восстановительная реакция.
Рисунок 23.3
Гальванический элемент.
Гальванический элемент (см. Рисунок выше) состоит из двух отдельных отсеков. Полуэлемент — это часть гальванического элемента, в котором происходит полуреакция окисления или восстановления.Левая полуячейка представляет собой полоску металлического цинка в растворе сульфата цинка. Правая полуячейка представляет собой полоску металлической меди в растворе сульфата меди (II). Полоски металла называются электродами. Электрод — это проводник в цепи, который используется для переноса электронов к неметаллической части цепи. Неметаллическая часть схемы — это растворы электролита, в которых размещены электроды. Металлический провод соединяет два электрода. Переключатель размыкает или замыкает цепь.Между двумя полуячейками помещена пористая мембрана, замыкающая цепь.
Полоски металла называются электродами. Электрод — это проводник в цепи, который используется для переноса электронов к неметаллической части цепи. Неметаллическая часть схемы — это растворы электролита, в которых размещены электроды. Металлический провод соединяет два электрода. Переключатель размыкает или замыкает цепь.Между двумя полуячейками помещена пористая мембрана, замыкающая цепь.
Различные электрохимические процессы, происходящие в гальваническом элементе, происходят одновременно. Проще всего описать их в следующих шагах, используя в качестве примера вышеуказанный цинк-медный элемент.
1. Атомы цинка из цинкового электрода окисляются до ионов цинка. Это происходит потому, что содержание цинка в ряду активности выше, чем меди, и поэтому он легче окисляется.
Электрод, на котором происходит окисление, называется анодом .Цинковый анод постепенно уменьшается по мере работы элемента из-за потери металлического цинка. Концентрация ионов цинка в полуячейке увеличивается. Из-за образования электронов на аноде он обозначается как отрицательный электрод.
Концентрация ионов цинка в полуячейке увеличивается. Из-за образования электронов на аноде он обозначается как отрицательный электрод.
2. Электроны, которые генерируются на цинковом аноде, проходят через внешний провод и регистрируют показания вольтметра. Они продолжаются до медного электрода.
3. Электроны входят в медный электрод, где они соединяются с ионами меди (II) в растворе, превращая их в металлическую медь.
Электрод, на котором происходит восстановление, называется катодом . Катод постепенно увеличивается в массе из-за образования металлической меди. Концентрация ионов меди (II) в полуячейке уменьшается. Катод — положительный электрод.
4. Ионы проходят через мембрану, сохраняя электрическую нейтральность в клетке. В ячейке, показанной выше, сульфат-ионы будут перемещаться со стороны меди на сторону цинка, чтобы компенсировать уменьшение Cu 2+ и увеличение Zn 2+ .
Две половинные реакции можно снова суммировать, чтобы получить общую окислительно-восстановительную реакцию, происходящую в гальваническом элементе.
Сводка
- Описана конструкция гальванического элемента.
- Приведены реакции с образованием электронного потока.
Практика
Вопросы
Ознакомьтесь с материалом по ссылке ниже и ответьте на следующие вопросы:
http://chemed.chem.wisc.edu/chempaths/GenChem-Textbook/Galvanic-Cells/chemprime/CoreChem3AElectrochemical_Cells-699.html
- В чем разница между электролитической ячейкой и гальванической ячейкой?
- Где происходит реакция окисления в гальваническом элементе?
- Где протекает реакция восстановления?
- Перечислите несколько примеров гальванических элементов, имеющих коммерческое значение.
Обзор
Вопросы
- Что делает гальванический элемент?
- Почему два электрода физически разделены?
- Для чего нужна пористая мембрана?
- анод: Электрод, на котором происходит окисление.

- катод: Электрод, на котором происходит восстановление.
- электрод: Проводник в цепи, который используется для переноса электронов к неметаллической части цепи.
- полуэлемент: Часть гальванического элемента, в которой происходит полуреакция окисления или восстановления.
- гальванический элемент: Электрохимический элемент, использующий спонтанную окислительно-восстановительную реакцию для производства электроэнергии.
- Определите электрический потенциал.
- Определите потенциал уменьшения.
- Определите потенциал ячейки.
Сколько это вольт?
Вольтметр не измеряет напряжение напрямую; он измеряет электрический ток. Но не волнуйтесь — ток и напряжение могут быть напрямую связаны друг с другом. Первые измерители назывались гальванометрами, и они использовали основные законы электричества для определения напряжения. Они были тяжелыми и трудными в работе, но свою работу выполняли.Первые мультиметры были разработаны в 1920-х годах, но настоящая портативность должна была подождать, пока печатные схемы и транзисторы не заменили громоздкие провода и электронные лампы.
Они были тяжелыми и трудными в работе, но свою работу выполняли.Первые мультиметры были разработаны в 1920-х годах, но настоящая портативность должна была подождать, пока печатные схемы и транзисторы не заменили громоздкие провода и электронные лампы.
Электрический потенциал
Электрический потенциал — это измерение способности гальванического элемента производить электрический ток. Электрический потенциал обычно измеряется в вольтах (В). Напряжение, создаваемое данным гальваническим элементом, представляет собой разность электрических потенциалов между двумя полуэлементами.Невозможно измерить электрический потенциал изолированной полуячейки. Например, если был сконструирован только цинковый полуэлемент, полная окислительно-восстановительная реакция не могла бы произойти, и поэтому невозможно было бы измерить электрический потенциал. Только когда другая полуэлемент объединяется с цинковым полуэлементом, можно измерить электрическую разность потенциалов или напряжение.
Электрический потенциал клетки возникает в результате конкуренции за электроны. В цинково-медном гальваническом элементе именно ионы меди (II) восстанавливаются до металлической меди.Это потому, что ионы Cu 2+ имеют большее притяжение для электронов, чем ионы Zn 2+ в другой полуячейке. Вместо этого металлический цинк окисляется. Потенциал восстановления является мерой тенденции данной полуреакции протекать как восстановление в электрохимической ячейке. В данном гальваническом элементе полуэлемент, который имеет больший восстановительный потенциал, — это тот, в котором происходит восстановление. В полуячейке с более низким потенциалом восстановления произойдет окисление.Потенциал ячейки (ячейка E ) — это разность потенциалов восстановления между двумя полуячейками в электрохимической ячейке.
Сводка
- Даны определения типа электрического потенциала.
Практика
Вопросы
Ознакомьтесь с материалом по ссылке ниже и ответьте на следующие вопросы:
http://www. nobelprize.org/nobel_prizes/chemistry/laureates/1920/nernst-bio.html
nobelprize.org/nobel_prizes/chemistry/laureates/1920/nernst-bio.html
- Где родился Нернст?
- Какую теорию он разработал в 1889 году?
- Какой музыкальный инструмент он разработал, что не понравилось музыкантам?
Обзор
Вопросы
- Почему мы не можем измерить электрический потенциал изолированной полуячейки?
- О чем говорит нам потенциал сокращения?
- Каков потенциал клетки?
- потенциал ячейки (E cell ): Разница в потенциале восстановления между двумя полуячейками в электрохимической ячейке.
- электрический потенциал: Измерение способности гальванического элемента производить электрический ток.
- восстановительный потенциал: Мера тенденции данной полуреакции протекать как восстановление в электрохимической ячейке.
- Опишите водородный электрод.

- Опишите, как этот электрод используется для определения восстановительных потенциалов.
Что такое стандарт?
Все мы с кем-то сравниваем себя.Могу я бежать быстрее тебя? Я выше своего отца? Это относительные сравнения, которые не дают много полезных данных. Когда мы используем стандарт для наших сравнений, каждый может сказать, как одно сравнивается с другим. Один метр — это одинаковое расстояние во всем мире, поэтому 100-метровая трасса в одной стране — это точно такое же расстояние, как и 100-метровая трасса в другой стране. Теперь у нас есть универсальная база для сравнения.
Стандартный водородный электрод
Ряд активности позволяет нам предсказать относительную химическую активность различных материалов при использовании в окислительно-восстановительных процессах.Мы также знаем, что можем создать электрический ток с помощью комбинации химических процессов. Но как предсказать ожидаемое количество тока, которое будет проходить через систему? Мы измеряем этот поток как напряжение (электродвижущую силу или разность потенциалов).
Для этого нам нужен способ сравнения степени электронного потока в различных химических системах. Лучший способ сделать это — иметь базовый уровень, который мы используем — стандарт, по которому все можно измерить. Для определения токов и напряжений полуреакции мы используем стандартный водородный электрод . Рисунок ниже иллюстрирует этот электрод. Платиновый провод проводит электричество по цепи. Проволоку погружают в 1,0 М раствор сильной кислоты и барботируют газ H 2 при давлении в одну атмосферу и температуре 25 ° C. Половина реакции на этом электроде равна.
Рисунок 23.4
Стандартный водородный электрод.
В этих условиях потенциал восстановления водорода определяется как точно равный нулю.Мы называем это стандартным восстановительным потенциалом.
Затем мы можем использовать эту систему для измерения потенциалов других электродов в полуячейке. Во втором полуячейке находится металл и одна из его солей (часто используется сульфат). Мы будем использовать цинк в качестве нашего примера (см. рисунок ниже).
Мы будем использовать цинк в качестве нашего примера (см. рисунок ниже).
Рисунок 23,5
Стандартный водородный полуэлемент в паре с цинковым полуэлементом.
Наблюдая за реакцией, мы замечаем, что масса твердого цинка уменьшается в ходе реакции.Это говорит о том, что реакция, происходящая в этой полуячейке, равна
.Итак, в ячейке происходит следующий процесс:
, а измеренное напряжение ячейки составляет 0,76 В (сокращенно v).
Мы определяем стандартную ЭДС (электродвижущую силу) элемента как:
Мы можем сделать то же самое с медной ячейкой ( Рисунок ниже).
Рисунок 23.6
Стандартный водородный полуэлемент в паре с медным полуэлементом.
По мере того, как мы запускаем реакцию, мы видим, что масса меди увеличивается, поэтому запишем полуреакцию:
Это делает медный электрод катодом. Теперь у нас есть две полуреакции:
и определяем для системы 0. 34 v.
34 v.
снова,
Теперь мы хотим построить систему, в которой задействованы и цинк, и медь. Из ряда показателей активности мы знаем, что цинк будет окисляться и восстанавливаться медь, поэтому мы можем использовать имеющиеся значения:
Сводка
- Описана конструкция стандартного водородного электрода.
- Приведены примеры использования этого электрода для определения восстановительных потенциалов.
Практика
Вопросы
Посмотрите видео по ссылке ниже и ответьте на следующие вопросы:
Нажмите на изображение выше, чтобы увидеть больше
http://www.youtube.com/watch?v=mrOm6xZip6k
- Почему катион перемещается через солевой мостик в сторону водорода?
- Почему цинковый полуэлемент является анодом?
- Как определяется стандартный потенциал?
Обзор
Вопросы
- Каков определенный потенциал водородного электрода?
- Каков химический состав этого электрода?
- Каковы стандартные условия для другой полуячейки?
- стандартный водородный электрод: Стандартное измерение электродного потенциала для термодинамической шкалы окислительно-восстановительных потенциалов.

- Выполните расчет стандартного потенциала ячейки.
- Опишите способность материалов участвовать в окислительно-восстановительных реакциях на основе стандартных данных о потенциале клеток.
Устранение ржавчины
Под воздействием влаги сталь довольно быстро начинает ржаветь. Это создает значительную проблему для таких предметов, как гвозди, которые подвергаются воздействию атмосферы. Гвозди можно защитить, покрыв их металлическим цинком, сделав оцинкованный гвоздь.Цинк окисляется с большей вероятностью, чем железо в стали, поэтому он предотвращает развитие ржавчины на гвозде.
Расчет стандартных потенциалов ячеек
Для функционирования любой электрохимический элемент должен состоять из двух полуэлементов. Приведенная ниже таблица может быть использована для определения реакций, которые будут происходить, и стандартного потенциала клетки для любой комбинации двух полуэлементов без фактического построения клетки. Половина ячейки с более высоким потенциалом восстановления в соответствии с таблицей будет подвергаться восстановлению внутри ячейки.Половина ячейки с более низким потенциалом восстановления подвергнется окислению внутри ячейки. Если эти спецификации соблюдены, общий потенциал ячейки будет положительным значением. Потенциал клетки должен быть положительным, чтобы окислительно-восстановительная реакция клетки была спонтанной. Если бы был рассчитан отрицательный потенциал клетки, эта реакция была бы спонтанной в обратном направлении.
Половина ячейки с более высоким потенциалом восстановления в соответствии с таблицей будет подвергаться восстановлению внутри ячейки.Половина ячейки с более низким потенциалом восстановления подвергнется окислению внутри ячейки. Если эти спецификации соблюдены, общий потенциал ячейки будет положительным значением. Потенциал клетки должен быть положительным, чтобы окислительно-восстановительная реакция клетки была спонтанной. Если бы был рассчитан отрицательный потенциал клетки, эта реакция была бы спонтанной в обратном направлении.
| Стандартный восстановительный потенциал при 25 ° C | |
|---|---|
| Половина реакции | E или (В) |
| F 2 + 2e — → 2F — | +2.87 |
| PbO 2 + 4H + + SO 4 2− + 2e — → PbSO 4 + 2H 2 O | +1,70 |
| MnO 4 — + 8H + + 5e — → Mn 2+ + 4H 2 O | +1,51 |
| Au 3+ + 3e — → Au | +1,50 |
| Класс 2 + 2e — → 2Cl — | +1. 36 36 |
| Cr 2 O 7 2− + 14H + + 6e — → 2Cr 3+ + 7H 2 O | +1,33 |
| O 2 + 4H + + 4e — → 2H 2 O | +1.23 |
| Br 2 + 2e — → 2Br — | +1,07 |
| НЕТ 3 — + 4H + + 3e — → NO + 2H 2 O | +0.96 |
| 2Hg 2+ + 2e — → Hg 2 2+ | +0,92 |
| Hg 2+ + 2e — → Hg | +0,85 |
| Ag + + e — → Ag | +0,80 |
| Fe 3+ + e — → Fe 2+ | +0,77 |
| I 2 + 2e — → 2I — | +0. 53 53 |
| Cu + + e — → Cu | +0,52 |
| O 2 + 2H 2 O + 4e — → 4OH — | +0,40 |
| Cu 2+ + 2e — → Cu | +0,34 |
| Sn 4+ + 2e — → Sn 2+ | +0,13 |
| 2H + + 2e — → H 2 | 0.00 |
| Pb 2+ + 2e — → Pb | -0,13 |
| Sn 2+ + 2e — → Sn | -0,14 |
| Ni 2+ + 2e — → Ni | -0,25 |
| Co 2+ + 2e — → Co | -0,28 |
| PbSO 4 + 2e — → Pb + SO 4 2− | -0,31 |
| Cd 2+ + 2e — → Cd | −0. 40 40 |
| Fe 2+ + 2e — → Fe | -0,44 |
| Cr 3+ + 3e — → Cr | −0,74 |
| Zn 2+ + 2e — → Zn | −0,76 |
| 2H 2 O + 2e — → H 2 + 2OH — | -0,83 |
| Mn 2+ + 2e — → Mn | -1,18 |
| Al 3+ + 3e — → Al | -1.66 |
| Be 2+ + 2e — → Be | -1,70 |
| мг 2+ + 2e — → мг | -2,37 |
| Na + + e — → Na | -2,71 |
| Ca 2+ + 2e — → Ca | -2,87 |
| Sr 2+ + 2e — → Sr | -2,89 |
| Ba 2+ + 2e — → Ba | -2. 90 90 |
| руб. + + д — → | руб.-2,92 |
| К + + е — → К | -2,92 |
| CS + + e — → CS | -2,92 |
| Li + + e — → Li | −3,05 |
Пример задачи: расчет стандартных потенциалов ячейки
Рассчитайте стандартный потенциал гальванического элемента, который использует реакции полуэлементов Ag / Ag + и Sn / Sn 2+ .Напишите сбалансированное уравнение для общей реакции клетки. Определите анод и катод.
Шаг 1. Составьте список известных значений и спланируйте проблему.
Известный
Неизвестно
Серебряный полуэлемент подвергнется восстановлению, потому что его стандартный восстановительный потенциал выше. Оловянный полуэлемент подвергнется окислению. Общий потенциал ячейки можно рассчитать с помощью уравнения.
Общий потенциал ячейки можно рассчитать с помощью уравнения.
Шаг 2: Решить.
Перед сложением двух реакций количество электронов, потерянных при окислении, должно равняться количеству электронов, полученных при восстановлении. Реакцию серебряных полуэлементов необходимо умножить на два. После этого и добавления к реакции оловянных полуэлементов получается общее уравнение.
Рассчитан потенциал ячейки.
Шаг 3. Подумайте о своем результате.
Стандартный потенциал клетки положительный, поэтому реакция спонтанная, как написано.Олово окисляется на аноде, а ион серебра восстанавливается на катоде. Обратите внимание, что напряжение для восстановления ионов серебра не удваивается, даже несмотря на то, что половину реакции восстановления пришлось удвоить, чтобы сбалансировать общее окислительно-восстановительное уравнение.
Окислители и восстановители
Вещество, которое очень легко восстанавливается, является сильным окислителем. И наоборот, вещество, которое очень легко окисляется, является сильным восстановителем. Согласно стандартной таблице потенциалов клеток фтор (F 2 ) является сильнейшим окислителем.Он окислит любое вещество, указанное ниже в таблице. Например, фтор будет окислять металлическое золото в соответствии со следующей реакцией.
И наоборот, вещество, которое очень легко окисляется, является сильным восстановителем. Согласно стандартной таблице потенциалов клеток фтор (F 2 ) является сильнейшим окислителем.Он окислит любое вещество, указанное ниже в таблице. Например, фтор будет окислять металлическое золото в соответствии со следующей реакцией.
Металлический литий (Li) — сильнейший восстановитель. Он способен уменьшить количество любого вещества, указанного выше в таблице. Например, литий будет восстанавливать воду в соответствии с этой реакцией.
Использование приведенной выше таблицы позволит вам предсказать, возникнут реакции или нет. Например, металлический никель способен восстанавливать ионы меди (II), но не способен восстанавливать ионы цинка.Это связано с тем, что содержание никеля (Ni) ниже Cu 2+ , но выше Zn 2+ в таблице.
Сводка
- Описаны стандартные расчеты потенциала ячейки.
- Даны рекомендации по прогнозированию возможностей реакции с использованием стандартных клеточных потенциалов.

Практика
Прочтите материал по ссылке ниже и ответьте на вопросы в конце:
http://chemwiki.ucdavis.edu/Analytical_Chemistry/Electrochemistry/Voltaic_Cells/The_Cell_Potential#Problems
Обзор
Вопросы
- Какому типу реакции подвергнется полуэлемент с более высоким восстановительным потенциалом?
- Каким должен быть общий потенциал клетки, чтобы реакция была спонтанной?
- Является ли Zn 2+ более сильным или более слабым восстановителем, чем Mg 2+ ?
- Опишите устройство сухой камеры.
- Запишите реакции для обычного сухого элемента и сухого щелочного элемента.
- Опишите конструкцию свинцовой аккумуляторной батареи.
- Записать реакции для светодиодной аккумуляторной батареи.
Ой, больно
Алессандро Вольта разработал первый «гальванический элемент» в 1800 году (на фото выше). Эта батарея состояла из чередующихся дисков из цинка и серебра с кусочками картона, пропитанными рассолом, разделяющими диски. Поскольку в то время не было вольтметров (и понятия не было, что электрический ток был вызван потоком электронов), Вольте пришлось полагаться на другой показатель мощности батареи: количество произведенного удара (никогда не стоит проверять что-то на себе. ).Он обнаружил, что интенсивность удара возрастает с увеличением количества металлических пластин в системе. Приборы с двадцатью пластинами вызвали довольно болезненный шок. Хорошо, что у нас сегодня есть вольтметры для измерения электрического тока, а не метод «ткните пальцем и скажите, что вы чувствуете».
Эта батарея состояла из чередующихся дисков из цинка и серебра с кусочками картона, пропитанными рассолом, разделяющими диски. Поскольку в то время не было вольтметров (и понятия не было, что электрический ток был вызван потоком электронов), Вольте пришлось полагаться на другой показатель мощности батареи: количество произведенного удара (никогда не стоит проверять что-то на себе. ).Он обнаружил, что интенсивность удара возрастает с увеличением количества металлических пластин в системе. Приборы с двадцатью пластинами вызвали довольно болезненный шок. Хорошо, что у нас сегодня есть вольтметры для измерения электрического тока, а не метод «ткните пальцем и скажите, что вы чувствуете».
Аккумуляторы
Два варианта основного гальванического элемента — это сухой элемент и свинцовая аккумуляторная батарея.
Сухие камеры
Многие обычные батареи, такие как те, которые используются в фонариках или пультах дистанционного управления, представляют собой сухие гальванические элементы.Эти батареи называются сухими элементами, потому что электролит представляет собой пасту. Они относительно недороги, но служат недолго и не подлежат перезарядке.
Рисунок 23.7
Сухой цинк-углеродный элемент.
В сухом цинково-углеродном элементе анодом является цинковый контейнер, а катодом — углеродный стержень, проходящий через центр элемента. Паста состоит из оксида марганца (IV) (MnO 2 ), хлорида аммония (NH 4 Cl) и хлорида цинка (ZnCl 2 ) в воде.Полураакции для этого сухого элемента:
Анод (окисление):
Катод (восстановление):
Паста предотвращает свободное перемешивание содержимого сухой ячейки, поэтому солевой мостик не требуется. Углеродный стержень является только проводником и не подвергается восстановлению. Напряжение, создаваемое свежим сухим элементом, составляет 1,5 В, но уменьшается во время использования.
Щелочная батарея представляет собой разновидность угольно-цинковой батареи. Щелочная батарея не имеет углеродного стержня и использует пасту из металлического цинка и гидроксида калия вместо твердого металлического анода.Катодная полуреакция такая же, но анодная полуреакция отличается.
Анод (окисление):
Преимущества щелочной батареи в том, что она имеет более длительный срок хранения и не снижается напряжение во время использования.
Свинцовые аккумуляторы
Батарея представляет собой группу электрохимических ячеек, объединенных вместе как источник постоянного электрического тока при постоянном напряжении. Сухие элементы не являются настоящими батареями, поскольку они состоят только из одного элемента.Свинцовая аккумуляторная батарея обычно используется в качестве источника энергии в автомобилях и других транспортных средствах. Он состоит из шести соединенных вместе идентичных ячеек, каждая из которых имеет свинцовый анод и катод из оксида свинца (IV) (PbO 2 ), установленных на металлической пластине.
Рисунок 23.8
Свинцовые аккумуляторные батареи, используемые в автомобилях, состоят из шести идентичных электрохимических ячеек и являются перезаряжаемыми.
Катод и анод погружены в водный раствор серной кислоты, которая действует как электролит.Клеточные реакции:
Каждая ячейка свинцовой аккумуляторной батареи вырабатывает 2 В, таким образом, всего 12 В вырабатывается всей батареей. Он используется для запуска автомобиля или питания других электрических систем.
В отличие от сухого элемента, свинцовая аккумуляторная батарея является перезаряжаемой. Обратите внимание, что прямая окислительно-восстановительная реакция генерирует твердый сульфат свинца (II), который медленно накапливается на пластинах. Дополнительно снижается концентрация серной кислоты. Когда автомобиль работает нормально, его генератор подзаряжает аккумулятор, заставляя вышеуказанные реакции протекать в противоположном или несамопроизвольном направлении.
Эта реакция восстанавливает свинец, оксид свинца (IV) и серную кислоту, необходимые для правильного функционирования батареи. Теоретически свинцовый аккумулятор должен работать вечно. На практике перезарядка не эффективна на 100%, потому что часть сульфата свинца (II) падает с электродов и собирается на дне ячеек.
Сводка
- Приведены конструкции сухого элемента и батареи.
- Описаны химические реакции для обоих типов.
Практика
Вопросы
Ознакомьтесь с материалом по ссылке ниже и ответьте на следующие вопросы:
http://www.fueleconomy.gov/feg/fuelcell.shtml
также щелкните ссылку на батарею топливных элементов, выделенную на странице.
- Где водород попадает в топливный элемент?
- Как производятся электроны?
- Куда уходят электроны?
- Что является продуктом реакции топливного элемента?
Обзор
Вопросы
- Какой цели служит угольный стержень в сухом элементе?
- Где щелочная батарея получила свое название?
- Почему зарядка автомобильного аккумулятора неэффективна на 100%?
- аккумулятор: Группа электрохимических элементов, объединенных вместе как источник постоянного электрического тока с постоянным напряжением.
- Определите электролиз.
- Опишите действие и функцию электролитической ячейки.
У нас уже есть тепло?
В 1989 году двое ученых заявили, что они достигли «холодного синтеза», процесса соединения элементов друг с другом при комнатной температуре для получения энергии. Гипотеза заключалась в том, что синтез произведет больше энергии, чем требуется для того, чтобы этот процесс произошел. Их процесс включал электролиз тяжелой воды (молекулы воды, содержащие некоторое количество дейтерия вместо обычного водорода) на палладиевом электроде.Эти эксперименты не могли быть воспроизведены, а их научная репутация была подорвана. Однако в последние годы как промышленные, так и государственные исследователи по-новому взглянули на этот процесс. Изображенное выше устройство является частью государственного проекта, и НАСА также завершает некоторые исследования по этой теме. В конце концов, холодный синтез может быть не таким «холодным».
Ячейки электролитические
Гальванический элемент использует спонтанную окислительно-восстановительную реакцию для генерации электрического тока.Также можно поступить наоборот. Когда к электрохимической ячейке подается внешний источник постоянного тока, может протекать реакция, которая обычно не является спонтанной. Электролиз — это процесс, в котором электрическая энергия используется для того, чтобы вызвать несамопроизвольную химическую реакцию. Электролиз отвечает за внешний вид многих повседневных предметов, таких как позолоченные или посеребренные украшения и хромированные автомобильные бамперы.
Электролитическая ячейка — это устройство, используемое для проведения реакции электролиза.В электролитической ячейке электрический ток применяется для обеспечения источника электронов для запуска реакции в неспонтанном направлении. В гальванической ячейке реакция идет в направлении спонтанного высвобождения электронов. В электролитической ячейке поступление электронов от внешнего источника заставляет реакцию идти в противоположном направлении.
Рисунок 23.9
Ячейка Zn / Cu.
Спонтанное направление реакции между Zn и Cu — это окисление металлического Zn до ионов Zn 2+ , в то время как ионы Cu 2+ восстанавливаются до металлической Cu.Это делает цинковый электрод анодом, а медный электрод катодом. Когда те же полуэлементы подключаются к батарее через внешний провод, реакция происходит в противоположном направлении. Цинковый электрод теперь является катодом, а медный электрод — анодом.
Стандартный потенциал клетки отрицательный, что указывает на неспонтанную реакцию. Батарея должна быть способна выдавать не менее 1,10 В постоянного тока, чтобы реакция могла произойти. Еще одно различие между гальванической ячейкой и электролитической ячейкой — это знаки электродов.В гальваническом элементе анод отрицательный, а катод положительный. В электролитической ячейке анод положительный, потому что он подключен к положительной клемме батареи. Следовательно, катод отрицательный. Электроны все еще проходят через ячейку от анода к катоду.
Сводка
- Описывается функция электролитической ячейки.
- Приведены реакции, иллюстрирующие электролиз.
Практика
Вопросы
Посмотрите видео по ссылке ниже и ответьте на следующие вопросы:
Нажмите на изображение выше, чтобы увидеть больше
http: // www.youtube.com/watch?v=y4yYF8gSHdA
- Что было источником электричества?
- Для чего использовалась сталь, прикрепленная к электроду?
- Что используется для передачи электрического тока?
Обзор
Вопросы
- Какими будут продукты спонтанной реакции между Zn / Zn 2+ и Cu / Cu 2+ ?
- Откуда мы знаем, что реакция образования Cu 2+ не является спонтанной?
- Каким будет напряжение реакции, в которой металлический Zn образует Zn 2+ ?
- электролиз: Процесс, в котором электрическая энергия используется для возникновения несамопроизвольной химической реакции.
- электролитическая ячейка: Аппарат, используемый для проведения реакции электролиза.
- Опишите экспериментальную установку для электролиза воды.
- Напишите уравнения реакций, участвующих в процессе.
Больше энергии от солнца?
Поскольку ископаемое топливо становится все более дорогим и менее доступным, ученые ищут другие источники энергии. Водород долгое время считался идеальным источником, поскольку он не загрязняет окружающую среду при горении.Проблема заключалась в том, чтобы найти способы экономичного производства водорода. Один из новых подходов, который изучается, — это фотоэлектролиз — производство электричества с использованием фотоэлектрических элементов для расщепления молекул воды. Этот метод все еще находится на стадии исследования, но, похоже, в будущем он станет очень многообещающим источником энергии.
Электролиз воды
При электролизе воды образуются водород и кислород. Электролитическая ячейка состоит из пары платиновых электродов, погруженных в воду, в которую было добавлено небольшое количество электролита, такого как H 2 SO 4 .0 _ {\ text {cell}} = — 2.06 \ text {V} [/ latex]
Чтобы получить полную реакцию, полуреакцию восстановления умножали на два, чтобы уравнять электроны. Ионы водорода и гидроксид-ионы, образующиеся в каждой реакции, объединяются с образованием воды. H 2 SO 4 не расходуется в реакции.
Рисунок 23.10
Аппарат для производства газообразного водорода и кислорода электролизом воды.
Сводка
- Описан электролиз воды.
Практика
Вопросы
Посмотрите видео по ссылке ниже и ответьте на следующие вопросы:
Нажмите на изображение выше, чтобы увидеть больше
www.youtube.com/watch?v=HQ9Fhd7P_HA
- Какие электроды?
- Что такое источник питания?
- Что добавляется в воду для облегчения подачи электричества?
- В какой пробирке содержится водород?
Обзор
Вопросы
- Какие электроды используются в реакции?
- Почему используется серная кислота?
- На каком электроде появляется кислород?
- Запишите реакции электролиза расплавленного NaCl в ячейке Дауна.
- Напишите реакции электролиза водного раствора хлорида натрия.
Большой счет за электроэнергию
Производство NaOH — важный производственный процесс. Используются три различных метода, каждый из которых предполагает использование электричества. При расчете цены на гидроксид натрия, которую компания должна взимать для получения прибыли, необходимо учитывать стоимость электроэнергии. Для производства метрической тонны NaOH требуется 3300-5000 кВтч (киловатт-часов).Сравните это с мощностью, необходимой для содержания среднего дома. Таким же количеством электричества можно было обеспечить дом в течение 6-10 месяцев.
Электролиз расплавленного хлорида натрия
Расплавленный (жидкий) хлорид натрия может быть подвергнут электролизу для получения металлического натрия и газообразного хлора. Электролитическая ячейка, используемая в процессе, называется ячейкой Дауна (см. Рисунок ниже).
Рисунок 23.11
Ячейка Дауна используется для электролиза расплавленного хлорида натрия.
В ячейке Дауна жидкие ионы натрия восстанавливаются на катоде до жидкого металлического натрия. На аноде жидкие хлорид-ионы окисляются до газообразного хлора. Реакции и потенциалы клеток показаны ниже:
Для проведения этого электролиза батарея должна подавать более 4 вольт. Эта реакция является основным источником образования газообразного хлора и единственным способом получения чистого металлического натрия. Газообразный хлор широко используется при очистке, дезинфекции и в плавательных бассейнах.
Электролиз водного хлорида натрия
Логично предположить, что электролиз водного раствора хлорида натрия, называемого солевым раствором , даст тот же результат посредством тех же реакций, что и процесс в расплавленном NaCl. Однако реакция восстановления, которая происходит на катоде, не дает металлического натрия, потому что вместо этого восстанавливается вода. Это связано с тем, что потенциал восстановления для воды составляет всего -0,83 В по сравнению с -2,71 В для восстановления ионов натрия.Это делает уменьшение количества воды предпочтительным, поскольку его восстановительный потенциал менее отрицательный. Газообразный хлор по-прежнему образуется на аноде, как и при электролизе расплавленного NaCl.
Поскольку гидроксид-ионы также являются продуктом чистой реакции, важный химический гидроксид натрия (NaOH) получается в результате испарения водного раствора в конце гидролиза.
Сводка
- Описаны реакции электролиза расплавленного NaCl.
- Описаны реакции электролиза рассола.
Практика
Вопросы
Ознакомьтесь с материалом по ссылке ниже и ответьте на следующие вопросы:
http://www.citycollegiate.com/sblock1.htm
- Как натрий удаляется из клетки?
- Почему в систему добавлен CaCl 2 ?
- Почему металлический кальций не загрязняет производство натрия?
Обзор
Вопросы
- Какие продукты электролиза расплава NaCl?
- Какие продукты электролиза водного NaCl?
- Какой ион-наблюдатель не показан в общем уравнении электролиза водного NaCl?
- рассол: Водный раствор хлорида натрия.
- Ячейка Дауна: Аппарат, используемый для промышленного производства металлического натрия и газообразного хлора.
- Определите гальваническое покрытие.
- Напишите типичную реакцию гальваники.
Кто-нибудь знает, где мы находимся?
Астролябия (изображенная выше в разобранном виде) была устройством, используемым для изучения движения планет и проведения съемок. Большинство астролябий были сделаны из латуни, но эта покрыта золотом, которое стирается.Персидские мистики также использовали астролябию для наблюдения за звездами и составления астрологических предсказаний.
Гальваника
Многие декоративные предметы, например ювелирные изделия, изготавливаются с помощью электролитического процесса. Гальваника — это процесс, при котором ион металла восстанавливается в электролитической ячейке, а твердый металл осаждается на поверхность. На рисунке ниже показана ячейка, в которой металлическая медь должна быть нанесена на второй металл.
Рисунок 23.12
Гальваника второго металла медью.
Ячейка состоит из раствора сульфата меди и полоски меди, которая действует как анод. Металл (Me) — это катод. Анод соединен с положительным электродом батареи, а металл — с отрицательным электродом.
Когда цепь замкнута, металлическая медь с анода окисляется, позволяя ионам меди проникать в раствор.
Между тем ионы меди из раствора восстанавливаются до металлической меди на поверхности катода (второй металл):
Концентрация ионов меди в растворе практически постоянна.Это связано с тем, что в процессе гальваники металл переносится с анода на катод ячейки. Другие металлы, обычно наносимые на предметы, включают хром, золото, серебро и платину.
Сводка
- Описан процесс нанесения гальванических покрытий.
Практика
Вопросы
Посмотрите видео по ссылке ниже и ответьте на следующие вопросы:
Нажмите на изображение выше, чтобы увидеть больше
http: // www.youtube.com/watch?v=Q8Xo43sfLgY
- Какой раствор используется?
- Как он тестировал систему?
- Почему батареи лучше, чем настенные, для электрического тока?
- Что было анодом?
Обзор
Вопросы
- Что такое анод в процессе гальваники с использованием меди?
- Что обеспечивает электрический ток?
- Какие другие металлы можно наносить на предметы?
- гальваника: Процесс, при котором ион металла восстанавливается в электролитической ячейке, а твердый металл осаждается на поверхность.
Химическая борьба с мхом на газонах
Химическая борьба с мхом на газонах Химическая промышленность Борьба с мхом на лужайкахМох на лужайке указывает на то, что дерн плохо растет. Важно учитывать, что мох не убивает траву; это просто создает неблагоприятные условия для роста такие условия, как тень, плохой дренаж, плохое плодородие или уплотненный почва. Эти условия, а не мох, в конечном итоге вызывают трава вымирать.Если вы хотите избавиться от мха на газоне, сосредоточьтесь на улучшении условий для выращивания травы и не волнуйтесь о мох — он исчезнет сам по себе, когда трава наберет энергичность.
Гербициды а химический контроль оказывает на мох лишь кратковременное воздействие. Если использование гербицидов не сопровождается надлежащими экологическими и физическими управления, то начальным эффектом будет чистая грязь или грязь. Мхи в конечном итоге вернется, потому что дефицит газона, который привел вторжению мха, все еще существует.Когда одни гербициды используются симптомы, а не причина появления сорняков на лужайке. Кроме того, многие распространенные гербициды, такие как глифосат, неэффективны против мхов, по крайней мере, в некоторых условиях (Woodfill 1999; Roberts and Ziegenhagen 1999). Поэтому, если вы воспринимаете мха на лужайке, улучшите условия для выращивание травы, а не использование гербицидов.
Фотография справа: Лужайка с плохой рослостью трав и
мхи на открытых пространствах.
Глифосат
Один из самых распространенных Гербицидами, которые используются сегодня, является глифосат (например, в Round-Up). Этот гербицид часто неэффективен против мхов (Woodfill 1999; Roberts and Ziegenhagen 1999; Newmaster et al. 1999), но убивает мхи в другие случаи (Newmaster и другие. 1999). Это химическое вещество всасывается через листья, становится плотно связаны с почвой и разлагаются микробами.Провал можно увидеть много распространенных гербицидов против мхов на некоторых плантациях рождественских елок и других многолетних культурах, где конкурирующие высшие растения были убиты гербицидами, в результате чего зеленый ковер из мхов и других мохообразных. Ситуации Остается неясным, в каких случаях глифосат убивает мхи или нет.
Сульфат железа, Сульфат аммония и сульфат меди
Железо отпугивает мхи, в то время как мало влияет на траву.Однако железо не будет всегда убивайте мох. Может сильно «обжечь» мох. и сделать растение очень слабым. Если нужно избавиться от мха, его необходимо удалить и засеять на его место семена травы для густого газон. Даже в этом случае, если не изменить благоприятные для мха условия, мох со временем восстановится, и он не будет похож на приложение когда-либо применялось.
С мохом можно бороться с помощью продуктов, содержащих сульфат железа, и сульфат двухвалентного аммония.Хорошая смесь примерно 3 унции сульфата железа в 5 галлонах воды. Пять галлонов смесь следует распылить на площади 1000 кв. футов. Продукты такие как Moss-Out (сульфат железа и аммония) можно использовать для борьбы с мхом. Обратите внимание, что мох лучше не закрывать. продукт вдали от тротуаров и бетона проезжей части, потому что он испачкает бетон.
С мохом можно бороться путем опрыскивания сульфатом меди на норма от 2 до 5 унций в 4 галлонах воды.4 галлона будут быть достаточным, чтобы покрыть 1000 квадратных футов. Однако материал может испачкать ваши руки и одежду и может разъедать металл контейнеры. Ни один из этих материалов не представляет серьезной угрозы. в окружающую среду; на самом деле железо и сера являются важными элементами для успешного роста растений.
Лайм
Лайм — хороший продукт для контроля кислая среда на вашем газоне. Со временем кислая среда может нанести вред здоровью травы, ограничивая доступность важных питательных веществ.Путем известкования дерна, особенно с известь на основе кальция, можно нейтрализовать кислотность, создавая лучший газон и более сильный конкурент сорнякам и мху. В идеальный pH почвы для большинства газонов — «нейтральный», примерно от 6,5 до 7. pH менее 6 считается «кислым», а более 7 — «щелочным». Кислота почва часто ассоциируется с плохим плодородием и может способствовать рост мха на голых участках. Известняк — обычное средство используется для «нейтрализации» кислых почв. Если тест вашего газона показывает pH 4 или 5, затем применяя известняк дважды за вегетационный период, в в дополнение к регулярному внесению удобрений, следует значительно улучшить уровень pH.Не добавляйте известь, чтобы избавиться от мха. если анализ почвы не указывает на потребность в извести.
Удобрения
Причиной может быть плохое плодородие почвы для роста газонного мха. Если на лужайке растет мох которые кажутся сухими и солнечными, то вид мха, вероятно, вызвано плохим плодородием почвы. Чтобы узнать, есть ли низкая почва плодородие способствует возникновению проблемы мха, возьмите представителя образец почвы из мест, где обычно растет мох, и иметь его проверено.Если тесты показывают дефицит определенных питательных веществ, добавьте этих питательных веществ может облегчить проблему. Применяйте только удобрения если это необходимо. Чрезмерное оплодотворение может вызвать другие проблемы, включая заражение вредителями и, возможно, заражение грунтовых вод. В то же время ваша проблема со мхом останется неизменной, если низкий уровень почвы Изначально причиной не было плодородия.
Внесение удобрений удобрения с высоким содержанием азота могут оказать значительное влияние на мох уменьшение и поддерживает рост здорового газона.Ежемесячные заявки железа и калия в сочетании с азотом также являются полезный. Доступны специальные удобрения для борьбы с мхом. содержащие азот, калий и железо. Это самые эффективные в программе из четырех заявок в год, с подачей заявок на раннем этапе весна, конец весны, середина лета и начало осени. Как и все удобрения, внимательно прочтите и следуйте инструкциям на продукте.
Фотография справа: Участок, прошедший химическую обработку для борьбы с мхом.
Вернуться в главная страница этого раздела
Записи лекций Джона Штрауба
Записи лекций Джона ШтраубаХимия растворов сульфата меди и «Закон действия масс»
Медное соединение темно-синего цвета становится белым благодаря нагреванию, а затем снова становится синим за счет добавления воды.
Состав: пентагидрат сульфата меди, часовое стекло, пропановая горелка.
Процедура: Полный рецепт следует.
1. Поместите синие кристаллы пентагидрата сульфата меди в стекло часов.
2. Нагрейте кристаллы и наблюдайте за изменением цвета и характера кристаллов.
3. Дайте кристаллам остыть.
4. Добавьте капли воды к охлажденным кристаллам порошка и наблюдайте за превращением.
Понимание: Есть пять молекул воды, которые гидратируют молекулу сульфата меди, создавая темно-синие пентагидраты сульфата меди.Молекулы воды легко отталкиваются от тепла, увеличивая беспорядок в реакционной системе за счет образования водяного пара.
CuSO 4 · 5H 2 O (т) → CuSO 4 (т) + 5H 2 O (г)
Полученный безводный сульфат меди представляет собой почти белый кристаллический пудра. Красивый синий пентагидрат сульфата меди может быть восстановлен добавление воды из капельницы.CuSO 4 (т) + 5H 2 O (л) → CuSO 4 · 5H 2 O (т)
Синий сульфат меди содержится в минерале халькантите .Также известный как римский купорос , он долгое время очаровывал химиков и алхимиков и был центральным соединением в поисках философского камня. В то время как голубой купорос — это сульфат меди, зеленый купорос — это сульфат железа, а белый купорос — это сульфат цинка. В древние времена было обнаружено, что при нагревании минерального сульфата можно получить жидкость с запахом, которая после перегонки давала желтую жидкость без запаха, известную как купорос . Было обнаружено, что купорос растворяет человеческие ткани и вызывает коррозию большинства металлов.Мы знаем, что купорос — это серная кислота .Прозрачный раствор гидроксида аммония добавляют к бледно-голубому раствору сульфата меди, образуя ярко-синий осадок, который остается взвешенным у поверхности раствора.
Состав: пентагидрат сульфата меди, гидроксид аммония.
Процедура: Ниже приводится частичный рецепт.
1. Приготовьте раствор медного купороса.
2. Приготовьте раствор гидроксида аммония.
3. Добавьте к сульфату меди капли гидроксида аммония и наблюдайте за превращением.
Понимание: Водорастворимый сульфат меди образует в растворе ионы Cu (II). Растворимый гидроксид аммония производит ионы аммония и ионы гидроксида в растворе в равновесии с аммиаком и водой.
NH 4 OH (водн.) ↔ NH 3 (водн.) + H 2 O (л)
Молекулы аммиака реагируют с ионом меди с образованием комплексного иона Cu (II), координированного с четырьмя молекулами аммиака.Cu 2+ (водн.) + 4 NH 3 (водн.) → [Cu (NH 3 ) 4 ] 2+ (водн.)
Этот комплексный ион, в свою очередь, связывается с молекулой воды и сульфат-ионом, образуя продукты общей реакции.CuSO 4 (водн.) + 4 NH 4 OH (водн.) → Cu (NH 3 ) 4 SO 4 H 2 O (т) + 3 H 2 O (л)
К бледно-голубому раствору сульфата меди добавляют прозрачный раствор дигидрофосфата калия… более бледно-голубое решение!
Состав: пентагидрат сульфата меди, дигидрофосфат калия.
Процедура: Полный рецепт следует.
1. Приготовьте раствор медного купороса.
2. Приготовьте раствор дигидрофосфата калия.
3. Смешайте два раствора и наблюдайте за превращением.
Понимание: И сульфат меди, и дигидрофосфат калия растворимы в воде.Для наших целей мы будем описывать растворение дигидрофосфата калия как простое растворение ионов калия и дигидрофосфата.
CuSO 4 (водн.) + KH 2 PO 4 (водн.) → Cu 2+ (водн.) + SO 4 2- (водн.) + K + (водн.) + H 2 PO 4 — (водн.)
Образовавшиеся ионы могут затем смешаться в растворе, что приведет лишь к смешиванию ионов!Cu 2+ (водн.) + SO 4 2- (водн.) + K + (водн.) + H 2 PO 4 — (водн.) → Cu 2+ (водн.) + SO 4 2- (водн.) + K + (водн.) + H 2 PO 4 — (водн.)
Получающееся в результате чистое ионное уравнение может быть записано→
Не существует реакции между сульфатом меди и дигидрофосфатом калия.Количественная мера реактивности
Вопрос: Посредством этих реакций с участием сульфата меди можно исследовать фундаментальные принципы, лежащие в основе «Закона действия масс», в котором степень превращения реагентов в продукты количественно определяется как отношение химических активностей , называемое константой равновесия .Выразите константу равновесия для каждой из трех общих реакций.
Вы можете проверить свои ответы здесь.
Набор для тестирования пассивации сульфатом меди | Звездные Решения
Технические данные:
Описание:
Тест на сульфат меди предназначен для проверки эффективности пассивирующей обработки нержавеющей стали. Его также можно использовать для определения необходимости пассивации.
Целью теста на сульфат меди является определение наличия свободного железа, которое часто переносится на поверхность детали во время изготовления стальных компонентов.Принцип испытания основан на окислительно-восстановительной реакции, в результате которой растворенные ионы меди осаждаются или осаждаются на местах свободных частиц железа.
Этот тест рекомендуется для обнаружения свободного железа на поверхности аустенитных нержавеющих сталей серий 200 и 300, дисперсионно-закаленных нержавеющих сталей и ферритных нержавеющих сталей серии 400, содержащих минимум 16% хрома. Этот тест не рекомендуется для мартенситных нержавеющих сталей серии 400 или для ферритных нержавеющих сталей серии 400 с содержанием хрома менее 16%, поскольку эти стали обычно дают положительный результат независимо от наличия или отсутствия поверхностных анодных загрязнений («ложный отказ»). .Этот тест также не рекомендуется для участков, отмеченных лазером.
Физические свойства:
| Форма | Жидкость |
| Химический состав | Вода, медный купорос, серная кислота |
| Рабочая температура | Комнатная температура |
Упаковка:
Бутылка-капельница на 2 унции. Содержит раствор, достаточный для сотен тестов.
Процедура подачи заявки:
Испытуемый раствор наносят на поверхность образца (ов), представляющего партию пассивированных частей, с добавлением дополнительного раствора, если необходимо, чтобы поверхность оставалась влажной в течение не менее 6 минут.По окончании этого периода поверхность следует тщательно промыть и высушить, стараясь не повредить медные отложения, если они есть. На исследуемом образце не должно быть отложений меди, видимых невооруженным глазом.
Медный цвет на металлической поверхности (коричневый или розоватый, как пенни) указывает на то, что на поверхности все еще присутствует железо, и это считается ошибкой теста. Если реакции не происходит, тест считается пройденным.
Примечания по использованию:
Для получения наилучших результатов подождите несколько часов после пассивации перед тестированием.
Этот тест обычно используется как приемочный тест партии после пассивации. Это не подразумевается и не должно подразумеваться, что детали из нержавеющей стали до пассивационной обработки должны или обязательно будут демонстрировать неисправное состояние при этом испытании.
Состояние отказа можно легко обнаружить и подтвердить работоспособность раствора при нанесении раствора сульфата меди на кусок чистой углеродистой стали.
Технические услуги:
Для получения технической помощи обращайтесь в Stellar Solutions по телефону (847) 854-2800.
Стандарты:
При правильном использовании тест на сульфат меди соответствует требованиям стандартов ASTM A967, ASTM A380, ASTM B912, ASTM F1089, AMS 2700 и MIL-STD-753.
Другие стандарты и методы испытаний, в которых используется раствор сульфата меди, могут иметь другую концентрацию и могут не работать должным образом с конкретным составом, используемым для этого раствора.
Никакая гарантия не подразумевается и может быть предоставлена в письменной или устной форме без письменного разрешения Stellar Solutions, Inc.
Сульфат меди — обзор
7.2.2 Лихорадка от паров металлов
Лихорадка от паров металлов — это гриппоподобный синдром с лихорадкой, миалгиями, обильным потоотделением и другими симптомами, которые обычно возникают через 3-10 часов после сильного воздействия различных веществ. оксидов металлов. Симптомы обычно исчезают через 24-48 часов (Mueller and Seger, 1985). Сообщалось также о металлической лихорадке после воздействия медьсодержащих паров и мелкой пыли, причем первые сообщения относятся, по крайней мере, к началу двадцатого века (Hansen, 1911; Friberg and Thrysin, 1947).Было высказано предположение, что у шестнадцати рабочих, у которых после резки труб, содержащих 90% меди, 10% никеля и следы цинка, была повышенная концентрация меди в моче (Armstrong et al., 1983). О зависимости доза-ответ не сообщалось. Было высказано предположение, что доказательств того, что медь сама по себе может вызвать лихорадку от дыма от металла, недостаточно (Borak et al., 2000).
7.2.2.1 Гемолиз
Имеется несколько сообщений о случаях острого гемолиза после отравления сульфатом меди.В серии случаев из 35 взрослых пациентов, госпитализированных из-за отравления сульфатом меди, у 69% пациентов был диагностирован гемолиз, а среднее содержание гемоглобина у выживших составило 7,6 г / дл (Naha et al., 2012).
В пяти случаях из 123 острых отравлений сульфатом меди сообщалось об остром внутрисосудистом гемолизе (Ahasan et al, 1994). Не сообщалось о зависимости от дозы между уровнем меди в сыворотке и тенденцией к внутрисосудистому гемолизу.
Острый гемолиз также может возникать при болезни Вильсона (Członkowska et al., 2010). У пациентов с болезнью Вильсона с гемолизом наблюдалось заметное ингибирование ферментов эритроцитов (гексокиназа, АТФазы и глюкозо-6-фосфатдегидрогеназа), снижение антиоксидантного статуса (например, снижение уровня глутатиона) и повышение уровня нецерулоплазмин-связанной меди в сыворотке (Attri и др., 2006).
Сообщалось о гемолизе после нанесения растворов солей меди на большие участки обожженной кожи (Holtzman et al., 1966) или после введения меди через медьсодержащие полупроницаемые мембраны и медные трубки в кровоток во время гемодиализа (Blomfield et al., 1966). al., 1969; Манцлер и Шрайнер, 1970; Klein et al., 1972). В описании случая указывается на возможность того, что органические соединения меди, используемые в качестве фунгицидов (8-гидроксихинолат меди), также могут вызывать гемолиз с образованием метгемоглобинемии (Yang et al., 2004).
7.2.2.2 Воздействие на печень и почки
В течение 6 лет в Южном Бангладеш было пролечено 123 случая отравления медью с суицидальными намерениями. Смертность составила 25% (Ahasan et al., 1994). Это сопоставимо с показателем смертности в 23% среди 35 пациентов, госпитализированных из-за отравления сульфатом меди в Индии (Naha et al., 2012). При смертельных отравлениях чаще всего сообщается о полиорганной патологии (Kurisaki et al., 1988; Bhowmik et al., 2001; Naha et al., 2012). Не было обнаружено существенной разницы в средних концентрациях меди в сыворотке между легкими случаями отравления с симптомами только со стороны желудочно-кишечного тракта и тяжелыми случаями с проявлениями почек или печени. Средняя концентрация меди в сыворотке крови в 35 случаях отравления медью, о которых сообщалось в Индии, составляла около 1 мг / л, что незначительно отличается от контрольных значений (Naha et al., 2012).
Из 48 пациентов, госпитализированных в связи с острым отравлением сульфатом меди, у 13 пациентов развились почечные клинические симптомы, такие как анурия или олигурия (Chuttani et al., 1965). В двух случаях биопсия почек выявила отек и некроз канальцевых клеток, а в четырех случаях со смертельным исходом наблюдались некроз канальцевых клеток, скопление клубочков и в некоторых случаях гемоглобиновые цилиндры. Внутривенное введение сульфата меди привело к острой почечной недостаточности и олигурии без каких-либо желудочно-кишечных расстройств (Bhowmik et al., 2001). Обнаружена патогенная атрофия канальцев с интерстициальным фиброзом и очаговое хроническое интерстициальное воспаление, но клубочки практически не пострадали. В другом случае была обнаружена почечная недостаточность с некрозом эпителия канальцев и отеком мозгового вещества (Kurisaki et al., 1988). Почечная недостаточность, вызванная гемолизом, была вторым наиболее часто встречающимся осложнением (51%) среди 35 пациентов с отравлением сульфатом меди (Naha et al., 2012).
Желтуха часто наблюдается при отравлении сульфатом меди (Chuttani et al., 1965). Было высказано предположение, что желтуха может быть связана либо с гепатотоксичностью, либо с гемолизом (Chuttani et al., 1965). Могут быть обнаружены гепатомегалия и центрилобулярный некроз печени (Chuttani et al., 1965; Kurisaki et al., 1988). Острый гепатит наблюдался у 46% пациентов, госпитализированных с отравлением сульфатом меди (Naha et al., 2012). Сообщалось также о других менее распространенных, но тяжелых заболеваниях после отравления сульфатом меди, например циркуляторный шок, кровотечение из желудочно-кишечного тракта, коагулопатия и панкреатит (Ahasan et al., 1994; Naha et al., 2012).
Прочие окислительно-восстановительные реакции
Прочие окислительно-восстановительные реакцииХимики-органики дают следующее определение к реакции окисления:
Окисление : Реакция, увеличивающая количество связей с кислородом.
Редукция : Реакция, уменьшающая количество связей с кислородом.
Химики-органики классифицируют горения реакции как реакции окисления
Существует еще один метод классификации реакций окисления / восстановления
Окисление : Когда вид теряет электроны и становится более заряженным.
Сокращение : Когда вид получает электроны и становится более отрицательно заряженным.
Ниже приводится реакция окисления / восстановления (окислительно-восстановительная).
Железо — это Fe, а Fe 2 O 3 — красная ржавчина. O 2 — кислород. Ты может подумать, что для этого процесса требуется вода, но это не так, это просто ускоряет это. Обратите внимание, что утюг теперь связаны с кислородом. Он вышел из своего элементарного состояния бесплатно (Fe 0 ). к его ионное состояние (Fe 3+ ) Потому что железо потеряло электроны и стало положительно заряженным, оно было окисленный.Кислород был уменьшен. Электроны от железа перешли к кислороду. Каждый процесс окисления должен иметь соответствующее восстановление. Мы называем эти окислительно-восстановительные реакции, слово окислительно-восстановительный потенциал объединяет красный uction и ox idation.
Мы можем записать половину реакции на эту сумму реакция:
Окисление 4 Fe -> 4 Fe 3+ + 12 e —
Редукция 3 O 2 + 12 e — -> 6 О 2-
Некоторые металлы в своем элементарном состоянии более стабильны, чем другие. Золото, платина и серебро трудно окисляются. Другие металлы, такие как литий, магний и алюминий, легко поддаются обработке. окислить. Когда они окисляются, они переходят в свое ионное состояние. Если поместить металлический цинк в раствор Cu 2+ и SO 4 2- происходит интересная вещь. В цинк переходит в раствор, а медь начинает расплавляться в твердом состоянии. медь (Cu 0 ). Уравнение для этого —
Цинк и медь — твердые вещества, а ионы — в растворе. Обратите внимание, что сульфат (SO 4 2-) не является изменение во время реакции. Мы называем это ионы-наблюдатели. Почему это реакция происходит? Медь больше стабильнее цинка. Медь ниже цинк на серию активности.
Активный цикл.
Окислительно-восстановительные полуреакции для вышеупомянутого реакция будет:
Окисление : Zn (s) -> Zn 2+ ( водн. ) + 2e —
Сокращение : Cu 2+ ( водн. ) + 2e — -> Cu (s)
Окисление атома цинка высвобождает 2 электрона
Восстановление иона меди достигается принятием 2 электроны
Таким образом, похоже, что движение, или поток электронов от металлического цинка к ионам меди
Мы можем уловить энергию, произведенную в этой реакции, в аккумулятор. Батарея может использовать этот поток электронов для работы. О гальванических элементах читайте по телефону
.http://wine1.sb.fsu.edu/chm1046/notes/Electro/Voltaic/Voltaic.htm
или
http://sciborg.uwaterloo.ca/~cchieh/cact/c123/battery.html
В свинцово-кислотной аккумуляторной батарее используются свинец 0 (элементарный) и свинец 4+.
Окисление : Pb (s) -> Pb 2+ ( водн. ) + 2e —
Свинец отдает два электрона сквозь проволока и становится Pb 2+ , который объединяется с SO 4 2- превращаться в сульфат свинца (II).
Сокращение : Pb 4+ ( s ) + 2e — -> Пб 2+ ( водн. )
Свинец здесь начинается как Pb 4+ в сочетании с 2 O 2- . Это может взять два электрона из провода и превратиться в Pb 2+ , который объединяется с SO 4 2- с образованием сульфата свинца (II).
Опять же, как электроны проходят через провод, они создают напряжение, которое можно использовать для Работа.
.

 Во-первых, железо и медь как химические элементы оказывают разное воздействие на вегетационный процесс растений. Во-вторых, состав микроэлементов в медном и железном купоросах тоже не одинаков и применять их следует грамотно и осторожно.
Во-первых, железо и медь как химические элементы оказывают разное воздействие на вегетационный процесс растений. Во-вторых, состав микроэлементов в медном и железном купоросах тоже не одинаков и применять их следует грамотно и осторожно.

 Благодаря этому он подходит для удаления с коры мха, лишайника и паразитических грибов, с которыми сложно борются другие средства защиты растений. Например, доказан эффект в выведении парши, мучнистой росы, антракноза.
Благодаря этому он подходит для удаления с коры мха, лишайника и паразитических грибов, с которыми сложно борются другие средства защиты растений. Например, доказан эффект в выведении парши, мучнистой росы, антракноза. При заливании лучше использовать фильтр, так как частички медного купороса могут остаться нерастворёнными.
При заливании лучше использовать фильтр, так как частички медного купороса могут остаться нерастворёнными.

 Во время дождя никакие манипуляции не проводятся, а ветер помешает равномерно нанести препарат на лозу;
Во время дождя никакие манипуляции не проводятся, а ветер помешает равномерно нанести препарат на лозу;